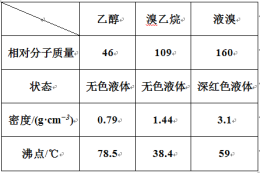
题目内容
【题目】某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,设计如下实验方案:
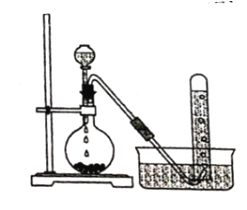
(方案1)称取一定质量的纯碱样品(已知锥形瓶和硫酸溶液的质量190.720 g),利用左图装置测定纯碱样品的纯度,每隔相同时间读得电子天平的数据如表:
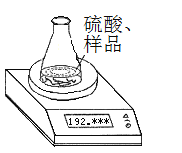
读数次数 | 质量(g) | |
锥形瓶+硫酸+试样 | 第1次 | 192.955 |
第2次 | 192.764 | |
第3次 | 192.328 | |
第4次 | 192.075 | |
第5次 | 192.075 |
(1)计算纯碱样品的纯度时,必需的数据是_____________________________(填具体数据)。不必作第6次读数的原因是________________________________________________。
(2)计算纯碱样品的纯度为_________________________(保留小数后两位)。
(方案2)测定上述样品(1.15 g)中,Na2CO3质量分数的另一种方案,其操作流程如下:
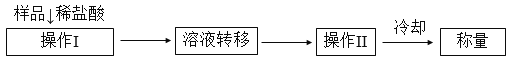
(1)溶液转移至__________(填写仪器名称),操作II的名称是______________。
(2)需直接测定的物理量是____________________。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要__________、__________(固定、夹持仪器除外)。
(4)在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果__________(填“偏小”、“偏大”或“不变”)
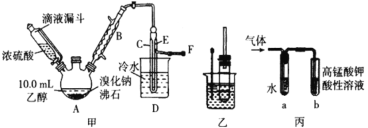
(方案3)实验装置如图:
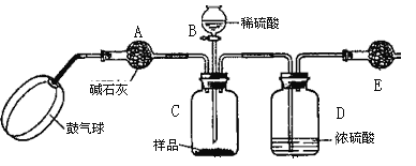
实验步骤:
①如图连接装置并加入所需药品。
②称量并记录E的质量m1(称量时注意封闭E的两端)。
③按动鼓气球,持续约1分钟。
④连接上E。
⑤打开分液漏斗B的活塞,将稀硫酸快速加入C中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录E的质量m2(称量时注意封闭E的两端及D右端的出口)。
⑧重复步骤⑥和⑦的操作,直到球形干燥管的质量基本不变,记为m3。
⑨计算。
请填空和回答问题:
(1)C中发生反应的离子方程式为:______________________________________。B仪器的名称为__________。如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将__________(填“偏高”、“偏低”或“不变”)。
(2)浓硫酸的作用是_________________,若没有D,则实验结果__________(填“偏高”、“偏低”或“无影响”)。
(3)步骤③和⑥的作用是____________________,____________________。鼓气球的速度是快速好,还是缓慢鼓入?为什么?__________________________________________。
(4)E装置的固体试剂为__________(填编号)
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.生石灰
(5)步骤⑧的目的是________________________________________________。
(6)试样中纯碱样品的质量分数计算式为_____________________________________。
(7)本实验设计中若有需要改进的地方,请指出该进之处并说明原因。
_______________________________________________________________________。
(8)实验还可以用其它定量实验方法测定试样中纯碱的质量分数,请简述一种不同的定量实验方法。___________________________________________________________ 。
【答案】192.955 g,192.075 g 第4次和第5次的数据相同,说明反应已完全进行 94.85% 蒸发皿 蒸发浓缩 冷却后,氯化钠的质量 玻璃棒 烧杯 偏大 ![]() 分液漏斗 偏高 吸收水蒸气 偏高 排出装置内的CO2 将装置内的CO2出,使其充分被E吸收 缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。 A 确保CO2被E吸收完全
分液漏斗 偏高 吸收水蒸气 偏高 排出装置内的CO2 将装置内的CO2出,使其充分被E吸收 缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。 A 确保CO2被E吸收完全 ![]() ×100% 有;在E的右端再连接一个相同的干燥装置 ①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。
×100% 有;在E的右端再连接一个相同的干燥装置 ①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。
【解析】
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,方案一根据碳酸钠和盐酸反应产生二氧化碳,气体散失后溶液质量发生变化,通过气体质量计算碳酸钠质量;方案二,反应后干燥蒸发,通过方程计算碳酸钠含量;方案三,用碱石灰吸收产生的二氧化碳,通过E增重计算碳酸钠的量。
方案一:(1)计算纯碱样品的纯度时,必需的数据是反应前的质量和反应终点时的质量,即192.955 g,192.075 g。不必作第6次读数的原因是第4次和第5次的数据相同,说明反应已完全进行;
(2)![]() ,纯碱样品的纯度
,纯碱样品的纯度![]() ;
;
方案二(1)溶液转移至蒸发皿,操作II的名称是蒸发浓缩;
(2)需直接测定的物理量是冷却后,氯化钠的质量。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要玻璃棒、烧杯;
(4)在转移溶液时,如溶液转移不完全,干燥后质量偏小,则Na2CO3质量分数的测定结果偏大;
方案3(1)C中发生反应是你碳酸钠和硫酸,离子方程式为:![]() 。B仪器的名称为分液漏斗。如果将分液漏斗中的硫酸换成浓度相同的盐酸,盐酸会部分挥发,进去碱石灰,测试的结果将偏高;
。B仪器的名称为分液漏斗。如果将分液漏斗中的硫酸换成浓度相同的盐酸,盐酸会部分挥发,进去碱石灰,测试的结果将偏高;
(2)浓硫酸具有吸水性,作用是吸收水蒸气,若没有D,碱石灰将吸收多余的水,则实验结果偏高;
(3)步骤③和⑥的作用是排出装置内的CO2,将装置内的CO2出,使其充分被E吸收。缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。
(4)E装置的固体试剂为碱石灰,无水氯化钙、浓硫酸和生石灰只能吸收水。
(5)步骤⑧反复操作,目的是确保CO2被E吸收完全。
(6)试样中纯碱样品的质量分数计算式为![]() ×100%。
×100%。
(7)装置E吸收反应产生的二氧化碳,但是与空气直接接触容易导致误差偏大,故有问题,应在E的右端再连接一个相同的干燥装置。
(8)实验还可以用沉淀法计算碳酸根质量,进而计算碳酸钠质量。①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。