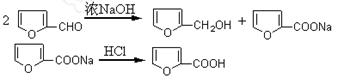
题目内容
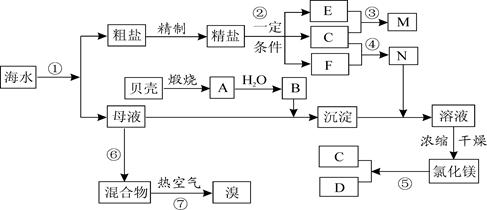
(14分)海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
请回答下列问题:
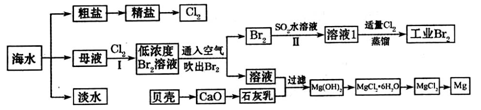
(1)请列举海水淡化的一种方法__________________________。
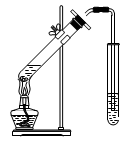
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br—,其目的是_____________________
___________________________________________________________________________。
(4)写出步骤II反应的离子方程式__________________________________________。
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。
(6)将MgCl2·6H2O直接加热能否得到MgCl2固体?_________。用化学方程式解释出原因_______________________________________________________________________。

请回答下列问题:
(1)请列举海水淡化的一种方法__________________________。
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br—,其目的是_____________________
___________________________________________________________________________。
(4)写出步骤II反应的离子方程式__________________________________________。
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。
(6)将MgCl2·6H2O直接加热能否得到MgCl2固体?_________。用化学方程式解释出原因_______________________________________________________________________。
(14分,除注明外,其余每空2分)
(1)蒸馏法(或电渗析法) (2)CCl4(1分) 分液漏斗
(3)浓缩、提纯溴元素(或富集溴元素) (4)Br2+SO2+2H2O=4H++SO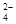 +2Br—
+2Br—
(5)氯化镁或MgCl2
(6)否;MgCl2+2H2O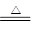 Mg(OH)2+2HCl↑ Mg(OH)2
Mg(OH)2+2HCl↑ Mg(OH)2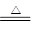 MgO+H2O
MgO+H2O
或MgCl2+H2O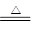 MgO+2HCl↑
MgO+2HCl↑
(1)蒸馏法(或电渗析法) (2)CCl4(1分) 分液漏斗
(3)浓缩、提纯溴元素(或富集溴元素) (4)Br2+SO2+2H2O=4H++SO
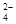 +2Br—
+2Br—(5)氯化镁或MgCl2
(6)否;MgCl2+2H2O
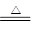 Mg(OH)2+2HCl↑ Mg(OH)2
Mg(OH)2+2HCl↑ Mg(OH)2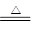 MgO+H2O
MgO+H2O或MgCl2+H2O
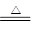 MgO+2HCl↑
MgO+2HCl↑考查海水资源的利用、物质的分离及提纯
(1)例如冷冻法、蒸馏法、电渗析法、离子交换法等
(2)萃取剂的选择标准,一是溴在其中的溶解度大,二是与原溶剂不能互溶,例如CCl4等,萃取时主要用到的是分液漏斗
(3)虽然溴元素在海水中的总含量较大,但其浓度较小,所以需要进行溴元素的富集
(4)两者发生氧化还原反应:Br2+SO2+2H2O=4H++SO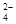 +2Br—
+2Br—
(5)由于Mg(OH)2的溶解度小于Ca(OH)2,可用MgCl2溶液来洗涤,破坏Ca(OH)2的溶解平衡,得到Mg(OH)2
(6)MgCl2为强酸弱碱盐,可水解,如果直接加热其晶体,促进其水解,并不能得到MgCl2固体,故一般在酸性氛围中加热脱水,以抑制其水解
(1)例如冷冻法、蒸馏法、电渗析法、离子交换法等
(2)萃取剂的选择标准,一是溴在其中的溶解度大,二是与原溶剂不能互溶,例如CCl4等,萃取时主要用到的是分液漏斗
(3)虽然溴元素在海水中的总含量较大,但其浓度较小,所以需要进行溴元素的富集
(4)两者发生氧化还原反应:Br2+SO2+2H2O=4H++SO
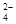 +2Br—
+2Br—(5)由于Mg(OH)2的溶解度小于Ca(OH)2,可用MgCl2溶液来洗涤,破坏Ca(OH)2的溶解平衡,得到Mg(OH)2
(6)MgCl2为强酸弱碱盐,可水解,如果直接加热其晶体,促进其水解,并不能得到MgCl2固体,故一般在酸性氛围中加热脱水,以抑制其水解

练习册系列答案
相关题目
 单质处循环
单质处循环 (填“甲”或“乙”),理由是 。
(填“甲”或“乙”),理由是 。
 不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。