��Ŀ����
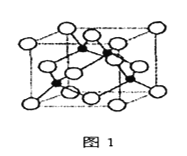
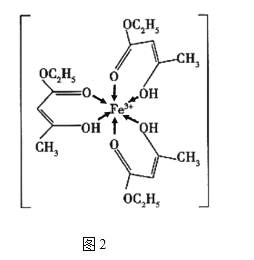
����Ŀ����������ͭ���仯�����ڿ�ѧ�о���ҵ�����о�����Ҫ����;����ͼ1��ʾͭ�����γɻ�����A�ľ���(�������ͭԭ��)��ͼ2��Fe3+���������������γɵ�������B��
�ش���������
��1����̬Cuԭ�ӵĺ�������Ų�ʽΪ____________________________��
��2����ԭ�ӽṹ�Ƕȷ�������һ������I1(Fe)��I1(Cu)�Ĺ�ϵ�ǣ�I1(Fe)________I1(Cu)(����>��<����=��)
��3��������A�Ļ�ѧʽΪ____________��Clԭ�ӵ���λ����____________��
��4��B��̼ԭ�ӵ��ӻ��������Ϊ________�����еĻ�ѧ��Ϊ________(����ĸ)��
a�����Ӽ� b�������� c�����Լ� d���Ǽ��Լ�
e����� f����� g������ h������
��5��������A������ˮ���������ڰ�ˮ����ԭ�������________________����NH3��Ϊ�ȵ�����ķ�����________________(д��ѧʽ��һ�ּ���)��NH3�ļ��Ǵ���H2O�ļ��ǵ���Ҫԭ����________________________________________��
��6����֪������A������ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪNA����þ���������Cuԭ��֮�����̾���Ϊ________________________nm(�г��������ʽ����)��
���𰸡� [Ar]3d104s1 �� 1s22s22p63s23p63d104s1 > CuCl 4 sp2��sp3 cdegh Cu+���백�γ�������ˮ����λ������������ӣ� PH3���� AsH3�Ⱥ����𰸣� NH3�� H2O ������ N�� O ԭ�ӵŵ��Ӷ����ֱ��� 1��2���µ��Ӷ���Խ�࣬�Գɼ����ӶԵ��ų���Խǿ������ԽС 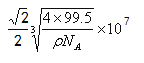
����������1��CuΪ29��Ԫ�أ���������Ų�Ϊ��[Ar]3d104s1������3d�ܼ���ȫ���ȶ��ṹ����
��2��Fe��Cu��һ�����ܶ���ʧȥ4s�ϵ�һ��������Ҫʧȥ��������Fe��4s����һ�Ե��ӣ�Cu��4s����һ�������ӣ�����Feʧȥ4s�ϵĵ�����Ҫ����ɶԵ����������������Ե�һ������I1(Fe)��I1(Cu)�Ĺ�ϵ�ǣ�I1(Fe)��I1(Cu)��
��3������ͼ�У�Clռ�ݾ�����8�������6�����ģ��У�![]() ����Cu���ھ�������4�������Ի�ѧʽΪCuCl��
����Cu���ھ�������4�������Ի�ѧʽΪCuCl��
��4��������B�����γ�4��������C�������γ�һ��˫����C��������sp3��sp2�ӻ�������ͼʾ�����д���������ʾ����λ����̼̼֮��ķǼ��Լ��������ļ��Լ�����������������˫�������������������Դ�Ϊcdegh��ע����������ǻ�ѧ�������ⲻ��������
��5��������A������ˮ���������ڰ�ˮ����ԭ��ֻ���������е�Cu+�Ͱ�ˮ�е�NH3�γ��������ӡ��ȵ������Ҫ����ԭ�����ͼ۵���������ͬ��������õķ����ǽ���ͬ����Ԫ�ش��������Դ�ΪPH3����NH3��H2O������ԭ�Ӷ���sp3�ӻ�������N��һ���µ��Ӷԣ�O�������µ��Ӷԣ�����O�Գɼ����ӶԵ�ѹ��Ӧ��ǿ��N�Գɼ����ӶԵ�ѹ�ȣ�����NH3�ļ��Ǵ���H2O�ļ�����
��6����ͼʾ������������Cu֮�����̾���Ϊ������Խ��ߵ�һ�룬�������߳���![]() ����������Ӧ�ú���4��CuCl����������Ϊ4��(64+35.5)��NA=
����������Ӧ�ú���4��CuCl����������Ϊ4��(64+35.5)��NA=![]() g��������ܶ�Ϊ��g��cm-3�����Ծ��������Ϊ
g��������ܶ�Ϊ��g��cm-3�����Ծ��������Ϊ![]() cm3�������ı߳�Ϊ
cm3�������ı߳�Ϊ![]() cm����
cm����![]() nm�����Ծ���������Cu֮�����̾���Ϊ
nm�����Ծ���������Cu֮�����̾���Ϊ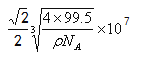 nm��
nm��