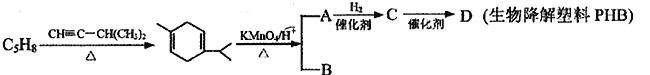题目内容
【题目】氢气是重要的化工原料,甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,工业上称为“甲烷蒸气转化法”。
(1)已知有关反应的能量变化如下图:
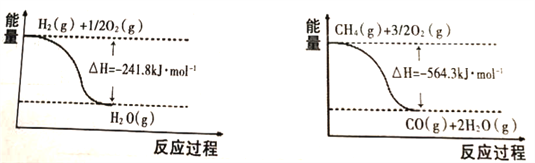
则甲烷和水蒸气反应生成一氧化碳和氢气的热化学方程式为_______________________________;
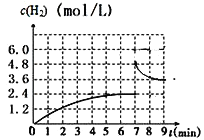
(2)已若该反应在700℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,反应中氢气浓度随时间的变化如右图,6min达到平衡。该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。由第一次平衡到第二次平衡,平衡移动的方向是_____________,采取的措施可能是___________________。
(3)右图中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________(填字母)。
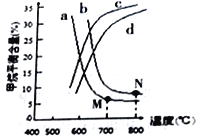
在实际生产中采用图中M点而不是N 点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是________________________________。
【答案】 CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH=+161.1kJ/mol 276.5mol2·L-2 逆反应方向 反应体积减小一半或加入等量H2 a 压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以M 点较为合适。
CO(g)+3H2(g) ΔH=+161.1kJ/mol 276.5mol2·L-2 逆反应方向 反应体积减小一半或加入等量H2 a 压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以M 点较为合适。
【解析】(1)由图1可知:①H2(g)+![]() O2(g)→H2O(g)△H=-241.8kJ/mol;②CH4(g)+
O2(g)→H2O(g)△H=-241.8kJ/mol;②CH4(g)+![]() O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;由盖斯定律可知,②-3×①得CH4(g)+H2O(g)
O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;由盖斯定律可知,②-3×①得CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,故答案为:CH4(g)+H2O(g)
CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,故答案为:CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+161.1kJ/mol;
CO2(g)+3H2(g)△H=+161.1kJ/mol;
(2) CH4(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
起始(mol/L): 1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
该温度下反应的平衡常数K=![]() =276.5mol2L-2;由图可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的
=276.5mol2L-2;由图可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的![]() 或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,故答案为:276.5mol2L-2;向逆反应方向;将容器体积缩小为原来的
或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,故答案为:276.5mol2L-2;向逆反应方向;将容器体积缩小为原来的![]() 或加入等量的氢气;
或加入等量的氢气;
(3)由CH4(g)+H2O(g)=CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以实际生产中采用图中M点而不是N点,故答案为:a;压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快。