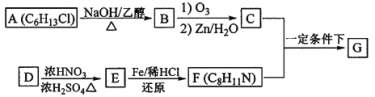
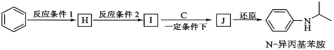
题目内容
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)___gH2O2中所含原子数与0.2molH3PO4所含原子数相等。
(2)同温同压下某容器中分别充满了O2、CO2及某气体X时的质量分别是116g、122g、114g,则气体X的相对分子质量是___。
(3)14.2g无水硫酸钠配制成500毫升溶液,其物质的量浓度为___;若从中取出50毫升溶液,其物质的量浓度为___,若将这50毫升溶液用水稀释到100毫升所得溶液中Na+的物质的量浓度为___。
【答案】13.6 28 0.2mol/L 0.2mol/L 0.2mol/L
【解析】
(1)根据0.2molH3PO4所含有的原子数为0.2mol×8=1.6mol进行解答;
(2)同温同压下,相同容积时,气体的物质的量相同.令气体的物质的量为n,容器质量为m,根据容器充满氧气与二氧化碳的质量,列方程计算n、m的值;根据M=![]() 可计算X气体的摩尔质量,据此计算气体X的相对分子质量;
可计算X气体的摩尔质量,据此计算气体X的相对分子质量;
(3)先计算硫酸钠的物质的量,再根据物质的量浓度公式计算溶液的物质的量浓度;根据溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关,从而判断50mL溶液的浓度;根据溶液稀释前后溶质的物质的量不变计算稀释后溶液的物质的量浓度。
(1)H3PO4分子中有8个原子,0.2molH3PO4中有1.6mol原子,H2O2分子中有4个原子,则0.4molH2O2中所含原子数与0.2molH3PO4所含原子数相等,其质量为0.4mol![]() 34g/mol=13.6g;
34g/mol=13.6g;
(2)令气体的物质的量为n mol,容器质量为m g,同温同压下某容器中分别充满了O2、CO2及某气体X时的质量分别是116g、122g,则有:m+n×32=116,m+n×44=122,解得,n=0.5,m=100。充满气体X后的质量为114g,所以气体X的质量为114g-100g=14g,物质的量为0.5mol,气体X的摩尔质量为![]() =28g/mol,所以气体X的相对分子质量为28;
=28g/mol,所以气体X的相对分子质量为28;
(3)硫酸钠的物质的量n=![]() =
=![]() =0.1mol,c=
=0.1mol,c=![]() =
=![]() =0.2mol/L;根据溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关,仍然为:0.2mol/L;溶液稀释前后溶质的物质的量不变得,c1V1=c2V2,c2=
=0.2mol/L;根据溶液浓度的均一性,所取溶液浓度与原溶液浓度一样,与所取溶液的体积大小无关,仍然为:0.2mol/L;溶液稀释前后溶质的物质的量不变得,c1V1=c2V2,c2=![]() =
=![]() =0.1mol/L,因此将这50毫升溶液用水稀释到100毫升所得溶液中Na+的物质的量浓度为0.2mol/L。
=0.1mol/L,因此将这50毫升溶液用水稀释到100毫升所得溶液中Na+的物质的量浓度为0.2mol/L。

【题目】2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。
已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。
(1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
A | 青蒿素在水中的溶解度很大 | B | 青蒿素含有亲脂的官能团 |
C | 在低温下提取青蒿素,效果会更好 | D | 乙二醇提取青蒿素的能力强于乙醚 |
(2)用下列实验装置测定青蒿素实验式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
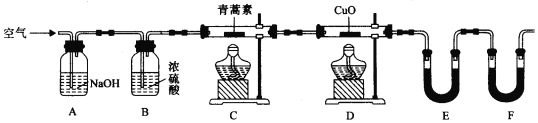
①装置D的作用是______,装置E中吸收的物质是______,装置F中盛放的物质是______。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是_____。