题目内容
【题目】对于周期表中下列位置的①~⑩十种元素,根据有关要求回答:
(1)能形成共价键的元素共有种。
(2)只需形成一个共价单键就能达到稳定结构的元素有(填元素符号)。
(3)气态氢化物溶于水生成的呈碱性的化合物是(填化学式)。
(4)⑩号元素最高正价含氧酸只含有键。
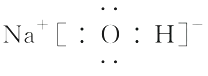
(5)①⑤⑦形成的化合物的电子式为。
(6)某元素的气态氢化物为H2B,其最高价氧化物中B的质量分数为40%,则其气态氢化物的电子式为 , 它与③的化合物的分子式为 , 含有的化学键类型有。
【答案】
(1)7
(2)H、F、Cl
(3)NH3·H2O
(4)共价
(5)
(6)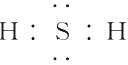 ;CS2;共价键
;CS2;共价键
【解析】 (1)①③④⑤⑥⑨⑩元素分别为H、C、N、O、F、S、Cl,它们形成单质或化合物时可形成共价键,共7种元素。
(2)只需形成一个共价单键就能达到稳定结构,原子最外层应该有7个电子或1个电子,它们分别是H、F、Cl元素。
(3)NH3分子溶于水形成呈碱性的化合物为NH3·H2O。
(4)HClO4分子中只含有共价键,没有离子键。
(5)H、O、Na形成的化合物为NaOH,Na+与OH-以离子键结合,OH-中O、H原子以共价键结合,其电子式为 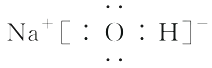 。
。
(6)某元素气态氢化物为H2B,则最高价氧化物为BO3 , 又知BO3中B的质量分数为40%,则B为S元素,其氢化物H2S的电子式为 ![]() 。S元素可与C元素形成CS2 , CS2中含有的化学键类型只有共价键。
。S元素可与C元素形成CS2 , CS2中含有的化学键类型只有共价键。
根据元素在元素周期表的性质,递变规律,位置推算出元素名称,再由已知元素的性质解答问题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目