题目内容
【题目】氧是地壳中含量最多的元素,据此回答问题。
(1)氧元素基态原子核外未成对电子数为。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为。 的沸点比
的沸点比 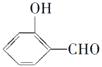 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+ , H3O+中O原子采用杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为。
【答案】
(1)2
(2)O—H键、氢键、范德华力;邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力增大
(3)sp3;H2O中O原子有2对孤对电子,H3O+中O原子只有1对孤对电子,排斥力较小
【解析】氧元素核外有8个电子,其基态原子核外电子排布为1s22s22p4 , 所以氧元素基态原子核外未成对电子数为2。(2)O—H键属于共价键,强度最大,分子间的范德华力和氢键均属于分子间作用力的范畴,但氢键要强于分子间的范德华力,所以它们从强到弱的顺序依次为O—H键、氢键、范德华力;氢键不仅存在于分子之间,有时也存在于分子内,邻羟基苯甲醛在分子内形成氢键,而在分子之间不存在氢键,对羟基苯甲醛正好相反,只能在分子间形成氢键,而在分子内不能形成氢键,所以对羟基苯甲醛的沸点比邻羟基苯甲醛的高。(3)依据价层电子对互斥理论知H3O+中O上的孤电子对数=![]() (5-3×1)=1,由于H3O+的中心原子O的价层电子对数为3+1=4,所以H3O+为四面体,因此H3O+中O原子采用的是sp3杂化;同理可以计算出H2O中O原子上的孤电子对数=
(5-3×1)=1,由于H3O+的中心原子O的价层电子对数为3+1=4,所以H3O+为四面体,因此H3O+中O原子采用的是sp3杂化;同理可以计算出H2O中O原子上的孤电子对数=![]() (6-2×1)=2,因此排斥力较大,水分子中H—O—H键角较小。
(6-2×1)=2,因此排斥力较大,水分子中H—O—H键角较小。
【考点精析】解答此题的关键在于理解氢键的存在对物质性质的影响的相关知识,掌握氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某兴趣小组制备氢氧化亚铁沉淀.
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
(1)实验1中产生白色沉淀的离子方程式是 .
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究: ①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物.查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是 .
②乙同学查阅文献:Fe(OH)2在大量SO42﹣存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐).并设计对比实验证实该假设:向试管中加入 , 再往试管中加入 , 振荡,现象与实验1相同,结论是该假设不成立.
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起.推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好.设计了如下实验方案:
试管中10mL | 滴加 | 实验现象 | |
实验2 | 6mol/L | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6mol/L | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是 , 能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是 . 丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是 , 证明该假设成立.
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为 .
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件 .

