题目内容
下列说法正确的是
| A.天然气、石油都是清洁的可再生能源 |
| B.在燃煤中添加碳酸钙或生石灰可以减少SO2的排放 |
| C.在AgC1饱和溶液中加入AgNO3溶液,达平衡时,溶液中Ksp(AgCl)降低 |
| D.地沟油和矿物油都属于酯类物质 |
B
解析试题分析:天然气和石油是不可再生能源,A错误;煤燃烧产生的SO2与加入的CaCO3或CaO反应生成CaSO3,并进一步被氧化成CaSO4,因此减少了SO2的排放,B正确;Ksp(AgCl)只与温度有关,温度不变,Ksp(AgCl)不变,C错误;地沟油是废弃的油脂,属于酯类,矿物油是烃类,D错误;故选择B。
考点:本题考查的是物质的分类、化学与生活、溶解平衡等知识。

 阅读快车系列答案
阅读快车系列答案甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+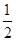 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
B.反应①中的能量变化如图所示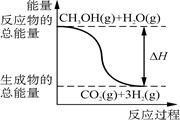 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+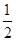 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+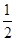 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
| A.△H=+244.1kJ/mol | B.△H=-488.3 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.复分解反应都是吸热反应 |
| B.NH4HCO3和盐酸的反应是吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是
| A.Q1 < Q2 < Q3 | B.Q1 > Q3 > Q2 | C.Q2 > Q1 > Q3 | D.Q1 < Q3 < Q2 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:
下列叙述正确的是( )。
| A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+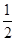 O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+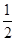 O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |