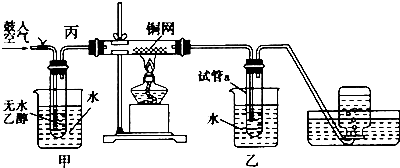
��Ŀ����
����Ŀ���ҹ���ѧ�Һ�°�ĸ����Ĵ����������գ����������̿ɼ�Ҫ��ʾ��ͼ1��ʾ�� 
��ش��������⣺
��1��������ʳ��ˮ��ͨ��������NH3��CO2 �� ��ͨ ��
��2������������ͼ��֪����ѭ���������� ��
��3��д�����������еĻ�ѧ����ʽ ��
��4��Ϊ�˼��麬��NaHCO3���ʵ�Na2CO3��Ʒ�Ĵ��ȣ��ֽ�W1g��Ʒ���ȵ����أ�������ΪW2g����ò�Ʒ�Ĵ��ȣ�������������ͼ2�е� ��
���𰸡�
��1��NH3
��2��CO2
��3��NH3+H2O+CO2+NaCl�TNH4Cl+NaHCO3����2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��4��A
���������⣺��1��������̼��ˮ�е��ܽ�Ƚ�С��������������ˮ������Ӧ����ͨ�������������ն�����̼�����Դ��ǣ�NH3����2���������Ƽ�ж�����̼�Ƿ�Ӧ��ԭ��ͬʱҲ�Ƿ�Ӧ�ĸ��������ѭ�����ã����Դ��ǣ�CO2����3���ڳ����ذ�����������̼��ˮ���Ȼ��Ʒ�����Ӧ����̼�����ƺ��Ȼ�泥���Ӧ����ʽΪNH3+H2O+CO2+NaCl�TNH4Cl+NaHCO3����̼�����Ʋ��ȶ����ڼ����������ֽܷ�����̼���ơ�ˮ�Ͷ�����̼����Ӧ����ʽΪ 2NaHCO3 ![]() Na2CO3+H2O+CO2�������Դ��ǣ�NH3+H2O+CO2+NaCl�TNH4Cl+NaHCO3����2NaHCO3
Na2CO3+H2O+CO2�������Դ��ǣ�NH3+H2O+CO2+NaCl�TNH4Cl+NaHCO3����2NaHCO3 ![]() Na2CO3+H2O+CO2������4������Ʒ�к���NaHCO3���ʵ�����Ϊx����
Na2CO3+H2O+CO2������4������Ʒ�к���NaHCO3���ʵ�����Ϊx����
2NaHCO3 | Na2CO3+CO2��+H2O | �������١�m |
2��84 | 106 | 62 |
x | ��w1g��w2g�� |
����2��84��62=x����w1g��w2g��
���x= ![]() g��
g��
��w��Na2CO3��=1�� ![]() =
= ![]() ��
��
��ѡA��