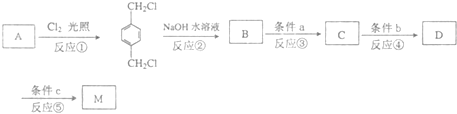
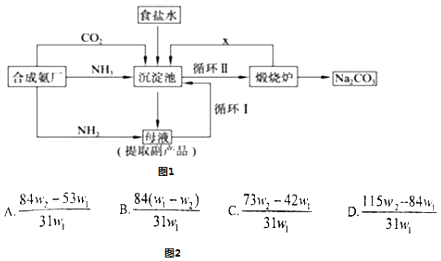
题目内容
【题目】向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42﹣)与c(Cl﹣)之比( )
A.3:2
B.1:7
C.2:7
D.3:14
【答案】D
【解析】解:向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,最后固体的质量与加入的铁粉的质量相等,则反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量,
假定反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量为56g,物质的量为 ![]() =1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
=1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
Fe+ | CuCl2=Cu+FeCl2 | 固体增重△m |
1mol | 64g﹣56g=8g | |
n(CuCl2) | 56g |
故n(CuCl2)= ![]() ×1mol=7mol,
×1mol=7mol,
故原溶液中c(SO42﹣):c(Cl﹣)=1mol×3:7mol×2=3:14
故选D.

【题目】现有部分短周期元素的性质或原子结构如下表:
元素 | 元素性质或原子的结构 |
T | 2p轨道能级电子数比s能级电子数多1个 |
X | L层p能级电子数比s能级电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有3个未成对电子 |
(1)写出元素X的离子结构示意图: . 写出元素Z的简单气态氢化物的电子式:
(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式: .
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是(填元素符号,下同);元素T与氯化素相比,非金属性较强的是 , 下列表述中能证明这一事实的是(填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.