题目内容
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)(1)X的原子结构示意图为


2
2
个未成对电子.(2)XZ与X2W都属于
离子
离子
晶体(写晶体类型);其熔点较高的是Na2O
Na2O
(写化学式),原因是氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大
氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大
.(3)YZ4和足量的水反应,生成一种弱酸和一种强酸,该反应的化学方程式是
SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+4H2O=H4SiO4↓+4HCl
.分析:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,据此解答.
解答:解:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,
(1)X为Na,原子核外电子数为11,原子结构示意图为 ;W为氧元素,其基态原子核外电子排布为1s22s22p4,核外有2个未成对电子,
;W为氧元素,其基态原子核外电子排布为1s22s22p4,核外有2个未成对电子,
故答案为: ;2;
;2;
(2)NaCl与Na2O都属于离子晶体,氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大,氧化钠熔点高,
故答案为:离子;Na2O;氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大;
(3)SiCl4和足量的水反应,生成一种弱酸和一种强酸,反应方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl.
(1)X为Na,原子核外电子数为11,原子结构示意图为
 ;W为氧元素,其基态原子核外电子排布为1s22s22p4,核外有2个未成对电子,
;W为氧元素,其基态原子核外电子排布为1s22s22p4,核外有2个未成对电子,故答案为:
 ;2;
;2;(2)NaCl与Na2O都属于离子晶体,氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大,氧化钠熔点高,
故答案为:离子;Na2O;氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大;
(3)SiCl4和足量的水反应,生成一种弱酸和一种强酸,反应方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl.
点评:本题考查位置结构性质关系、常用化学用语、晶体类型与性质等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.

练习册系列答案
相关题目
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大. (2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )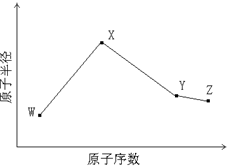 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.