题目内容
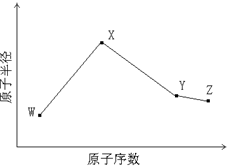
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素.
(1)X位于元素周期表的位置
第三周期、IA族
第三周期、IA族
,X与硫元素形成的化合物的电子式为

(2)Z的气态氢化物和溴化氢相比,较稳定的是
HCl
HCl
(写化学式).理由为氯元素的非金属性强于溴元素,所以HCl比HBr稳定
氯元素的非金属性强于溴元素,所以HCl比HBr稳定
.(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
范德华力(或分子间作用力)极性共价键(或共价键)
范德华力(或分子间作用力)极性共价键(或共价键)
其分子属于
非极性分子
非极性分子
(填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
.(4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
.分析:(1)质子数=原子序数=质量数-中子数,电子层越多则半径越大;
(2)原子的得电子能力越强则元素的非金属性越强,氢化物越稳定;
(3)分子晶体硬度小、熔点低、沸点低,晶体中有存在的作用力有范德华力(或分子间作用力)极性共价键(或共价键),根据反应物和生成物可以书写化学方程式;
(4)根据热化学方程式的书写原则结合反应的物质变化和能量变化进行书写.
(2)原子的得电子能力越强则元素的非金属性越强,氢化物越稳定;
(3)分子晶体硬度小、熔点低、沸点低,晶体中有存在的作用力有范德华力(或分子间作用力)极性共价键(或共价键),根据反应物和生成物可以书写化学方程式;
(4)根据热化学方程式的书写原则结合反应的物质变化和能量变化进行书写.
解答:解:W的一种核素的质量数为18,中子数为10,则W的质子数目为8,所以W为O,W、X、Y、Z四种常见的短周期元素的原子半径随原子序数的递增逐渐减小,所以X和Ne原子的核外电子数相差1时,只能为Na,Y的单质是一种常见的半导体材料,即为Si,Z是同周期中非金属性最强的元素,半径最小,所以为Cl.
(1)钠位于元素周期表的位置:第三周期、第IA族,硫化钠是离子化合物,电子式为: ,故答案为:第三周期、第IA族;
,故答案为:第三周期、第IA族; ;
;
(2)原子的得电子能力越强则元素的非金属性越强,氢化物越稳定,得电子能力:Cl>Br,所以气态氢化物较稳定的是HCl,故答案为:HCl;氯元素的非金属性强于溴元素,所以HCl比HBr稳定;
(3)SiCl4属于极性键构成的非极性分子,属于分子晶体,晶体中有存在的作用力有范德华力(或分子间作用力)极性共价键(或共价键);它和足量水反应,有白色胶状沉淀硅酸产生,故答案为:范德华力(或分子间作用力)极性共价键(或共价键);非极性分子;SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl;
(4)反应SiH4+2O2=SiO2+2H2O转移的电子数目相等为8mol,每转移1mol电子放热190.0kJ,所以SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol.
(1)钠位于元素周期表的位置:第三周期、第IA族,硫化钠是离子化合物,电子式为:
 ,故答案为:第三周期、第IA族;
,故答案为:第三周期、第IA族; ;
;(2)原子的得电子能力越强则元素的非金属性越强,氢化物越稳定,得电子能力:Cl>Br,所以气态氢化物较稳定的是HCl,故答案为:HCl;氯元素的非金属性强于溴元素,所以HCl比HBr稳定;
(3)SiCl4属于极性键构成的非极性分子,属于分子晶体,晶体中有存在的作用力有范德华力(或分子间作用力)极性共价键(或共价键);它和足量水反应,有白色胶状沉淀硅酸产生,故答案为:范德华力(或分子间作用力)极性共价键(或共价键);非极性分子;SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl;
(4)反应SiH4+2O2=SiO2+2H2O转移的电子数目相等为8mol,每转移1mol电子放热190.0kJ,所以SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol.
点评:本题是一道关于元素周期率的推断题,涉及的知识面广,题目综合性较强,难度较大.

练习册系列答案
相关题目
 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大. (2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( ) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.