题目内容
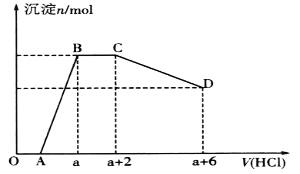
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1)写出物质F的名称__________,物质E的电子式__________。
(2)写出下列物质之间反应的化学方程式:
①F和CO2___________;
②D和E_______________,它________(填“是”或“不是” )可逆反应。
(3)物质G的化学式为______,写出它与I反应的离子方程式______。
【答案】过氧化钠 ![]() 2Na2O2+2CO2=2Na2CO3+O2 N2+3H2
2Na2O2+2CO2=2Na2CO3+O2 N2+3H2 ![]() 2NH3 是 Na2CO3 CO32-+2H+=H2O+CO2↑
2NH3 是 Na2CO3 CO32-+2H+=H2O+CO2↑
【解析】
化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na;G(Na2CO3,)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐为NH4Cl,故C为Cl2,据此分析解答。
根据上述分析,A为Na,B为O2,C为Cl2,D为H2,E为N2,F为Na2O2,G为Na2CO3,I为HCl,J为NH3,铵盐为NH4Cl。
(1)物质F是过氧化钠,物质E为N2,氮气的电子式为![]() ,故答案为:过氧化钠;
,故答案为:过氧化钠;![]() ;
;
(2)①F和CO2的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
②D和E的反应方程式为:N2+3H2![]() 2NH3,它是可逆反应,故答案为:N2+3H2
2NH3,它是可逆反应,故答案为:N2+3H2![]() 2NH3;是;
2NH3;是;
(3)G的化学式为Na2CO3,化合物G与I反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:Na2CO3;CO32-+2H+=CO2↑+H2O。

【题目】(1)已知25℃:
H2S | 一元酸HA |
Ka1=9.1×10—8,Ka2=1.1×10—12, | Ka=9.1×10—10 |
写出H2S与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式:______________________。
(2)次磷酸(H3PO2)是一种化工产品,具有较强的还原性。
①H3PO2是一元弱酸,写出其电离方程式____________________ 。
②H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、“中性”或“弱碱性”)。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式)。
(3)向NH4Al(SO4)2溶液中滴加1molL—1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。(滴加过程无气体放出)
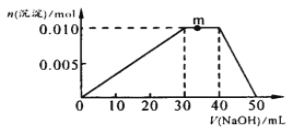
①写出m点发生反应的离子方程式_____________________________________。
②往NH4Al(SO4)2溶液中改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_____________mol 。