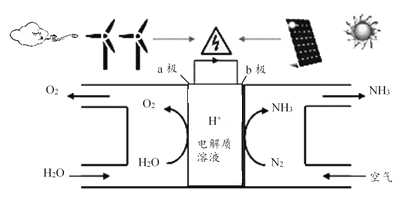
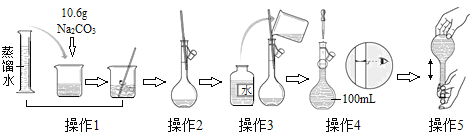
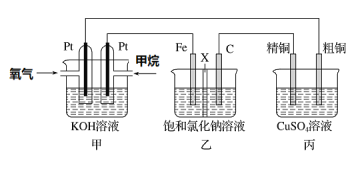
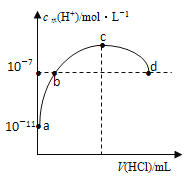
题目内容
【题目】工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)CO2(g)+H2(g)。
(1)平衡常数的表达式K=_________________________
(2)向1L恒容密闭容器中充入CO和H2O(g),某温度时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为__________;该温度下反应的平衡常数K=________(小数点后保留2位有效数字)。
(3)已知该反应在不同的温度下的平衡常数数值分别为
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.19 | 1.00 | 0.60 | 0.38 |
①根据表中的数据判断,该反应为________(填“吸热”或“放热”)反应。
②800℃,向2L恒容密闭容器中充入1molCO(g)、1molH2O(g)、2molCO2(g)、2molH2(g),此时v正_______v逆 (填“>”“<”或“=”)。
【答案】![]() 0.15 mol·L-1·min-1 1.19 放热 <
0.15 mol·L-1·min-1 1.19 放热 <
【解析】
(1)平衡常数的表达式K=![]() ;
;
(2)根据表格,计算2min内CO的反应速率,根据反应速率之比等于反应计量系数之比,则v(H2)=v(CO);反应进行到3min时,反应达到平衡状态,列三段式计算解答;
(3)①升高温度,平衡常数减小,平衡逆向移动,据此分析判断。
②根据题中数据列式计算Qc,与同温度下的平衡常数K比较,判断反应进行的方向,进而确定正逆反应速率的大小。
(1)已知反应:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数的表达式K=![]() =
=![]() ;
;
(2)根据表格,则从反应开始到2min时,CO的物质的量的变化量为0.3mol,体积为1L,则CO的物质的量浓度的变化量为0.3mol/L,2min 内,v(CO)=![]() =0.15 mol·L-1·min-1.,反应速率之比等于反应计量系数之比,则v(H2)=v(CO)=0.15 mol·L-1·min-1;
=0.15 mol·L-1·min-1.,反应速率之比等于反应计量系数之比,则v(H2)=v(CO)=0.15 mol·L-1·min-1;
反应进行到3min时,反应达到平衡状态,列三段式:

则平衡常数K=![]() ≈1.19;
≈1.19;
(3)①由表格数据可知,升高温度,平衡常数减小,平衡逆向移动,则正反应为放热反应;
②800℃,向2L恒容密闭容器中充入1molCO(g)、1molH2O(g)、2molCO2(g)、2molH2(g),则Qc= ,800℃时,K=1.19,则Qc>K,平衡向逆向移动,则v正<v逆。
,800℃时,K=1.19,则Qc>K,平衡向逆向移动,则v正<v逆。

 53随堂测系列答案
53随堂测系列答案