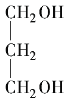题目内容
【题目】为了确定CH3COOH、![]() 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
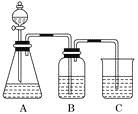
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________。
(2)装置B中盛放的试剂是________,它的作用是______________________。
(3)实验中观察到C中出现的主要现象是____________________________。
【答案】2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ 饱和NaHCO3溶液 除去CO2中可能混有的CH3COOH C中溶液变浑浊
【解析】
(1)苯酚的酸性比H2CO3的弱,故将CO2通入![]() 溶液中可制得苯酚,从而证明酸性H2CO3>
溶液中可制得苯酚,从而证明酸性H2CO3>![]() ,因此装置A的目的是制取CO2,锥形瓶中装有一种易溶于水的正盐固体,可为Na2CO3,分液漏斗中盛放的为CH3COOH,二者反应的离子方程式为2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;
,因此装置A的目的是制取CO2,锥形瓶中装有一种易溶于水的正盐固体,可为Na2CO3,分液漏斗中盛放的为CH3COOH,二者反应的离子方程式为2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;
(2)装置B中盛放的是饱和NaHCO3溶液,目的是除去CO2中混有的CH3COOH,防止醋酸与苯酚钠发生反应,对实验造成干扰;
(3)装置C的目的是证明碳酸酸性强于苯酚,因此是CO2通入苯酚钠中,生成苯酚,苯酚在水中的溶解度低,会析出,因此溶液变浑浊。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目