题目内容
(9分)用右图所示装置进行中和热测定实验,请回答下列问题:
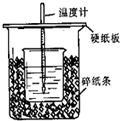
(1)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器是 。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ,
H2SO4与NaOH反应的热化学方程式为 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”.“不相等”),所求中和热 (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。

(1)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器是 。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ,
H2SO4与NaOH反应的热化学方程式为 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”.“不相等”),所求中和热 (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
(1) 保温、隔热、减少实验过程中的热量损失(1分); 环形玻璃搅拌棒(1分)
(2) -56.8kJ?mol-1 (2分) , H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1 (2分)
(3) 不相等 (1分) , 相等 (1分) , 偏小 (1分)
(2) -56.8kJ?mol-1 (2分) , H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1 (2分)
(3) 不相等 (1分) , 相等 (1分) , 偏小 (1分)
试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)Q= 3.4°C×4.18J/(g?℃)×100g=1421.2J=1.42KJ,
△H =
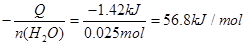 ;热化学方程式为:
;热化学方程式为:H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
点评:本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大。

练习册系列答案
相关题目
 FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1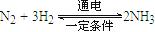 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。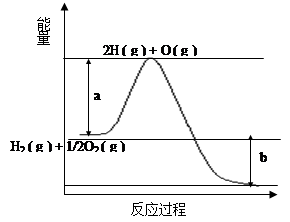
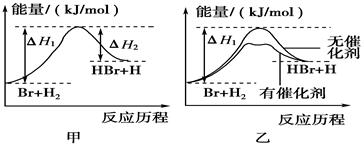
 ,则氢气燃烧的热化学方程式为
,则氢气燃烧的热化学方程式为