题目内容
【题目】(1)镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除CO。已知:

则用SO2除去CO的热化学方程式为___。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:

①B是电池的___极(填“正”或“负”);
②A极的电极反应式为____。
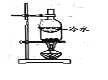
(3)利用双模三室电解法不仅可处理含NiCl2的废水,还可回收金属镍,其装置如图所示。
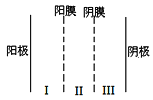
①两端电解质溶液分别为含NiCl2的废水和NaOH溶液,其中含NiCl2的废水应进___(填“Ⅰ”“Ⅱ”“Ⅲ”,下同)室。
②阳极的电极反应式为___。
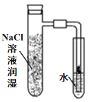
(4)某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol·L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。
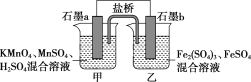
回答下列问题:
①此原电池的正极是石墨___(填“a”或“b”),发生___反应。
②电池工作时,盐桥中的SO42-移向____(填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为____;
【答案】SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol 负极 ![]() +2e-+H+═
+2e-+H+═![]() +Cl- III 4OH--4e-=O2↑+2H2O a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O
+Cl- III 4OH--4e-=O2↑+2H2O a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O
【解析】
(1)依据图示信息可知①S(s)+O2(g)=SO2(g) △H=-akJ/mol,
②CO(g) +![]() O2(g) =CO2(g) △H=-bkJ/mol;
O2(g) =CO2(g) △H=-bkJ/mol;
依据盖斯定律②×2-①得到:SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol;
故答案为:SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol;
(2)①由氢离子的定向移动可知A为正极,B为负极;
②A为正极,正极上发生得电子的还原反应:![]() +2e-+H+═
+2e-+H+═![]() +Cl-;
+Cl-;
(3)①电解池工作时,阳极发生氧化反应,阴极发生还原反应。由电解的目的知,镍元素从+2价降低为0价,发生还原反应,因此,含NiCl2的废水应在阴极室,即图示装置中的III室;
②Ⅱ室中的溶液为NaOH溶液,电解过程中,Na+通过阴膜迁移到II室,OH-通过阳膜迁移到I室,并在阳极,上发生氧化反应,电极反应式为: 4OH--4e-=O2↑+2H2O;
(4)①根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极;
②电池工作时,SO42-向负极移动,即向乙烧杯移动;
③甲烧杯中的电极为正极,正极上MnO4-得电子产生Mn2+,电极反应式为MnO4-+5e-+8H+=Mn2++4H2O。

 名校课堂系列答案
名校课堂系列答案