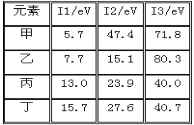
题目内容
【题目】H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为
(2)比较C、N、Al的第一电离能(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为(用化学式表示)
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应
(6)Ca和F形成的某离子晶体结构如图所示,Ca2+的配位数为 . 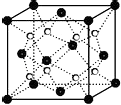
【答案】
(1)3d84s2
(2)N>C>Al
(3)Al2O3>CuO>CO2
(4)sp2杂化
(5)Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2
(6)8
【解析】解:(1)Ni是28号元素,外围电子排布式为3d84s2 , 所以答案是:3d84s2;(2)同周期元素从左到右元素的第一电离能逐渐增大,则N>C>Al,所以答案是:N>C>Al;(3)Cu、Al、C的最高价氧化物分别为氧化铜、氧化铝、二氧化碳,二氧化碳为分子晶体,氧化铜、氧化铝都为离子晶体,氧化铝中铝离子半径较小,电荷较多,则氧化铝晶格能较大,沸点较高,应为Al2O3>CuO>CO2 , 所以答案是:Al2O3>CuO>CO2;(4)气态有机物由C、O、H三种元素组成,为HCHO,C形成3个δ键,没有孤对电子,为sp2杂化,所以答案是:sp2杂化;(5)NiOOH转化为Ni(OH)2 , Mi元素化合价降低,被还原,为正极反应;碱性条件下Al被氧化生成NaAlO2 , 则反应的方程式为Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2 , 所以答案是:Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2;(6)Ca和F形成的离子化合物为CaF2 , 由晶胞可知Ca2+位于定点,每个晶胞中有1个F﹣与Ca2+距离最近,而定点为8个晶胞共有,则配位数为8,所以答案是:8.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案