题目内容
【题目】已知H2SO3+I2+H2O=H2SO4+2HI,将0.1molCl2通入100ml含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是
A.物质的还原性:HI>H2SO3>HCl
B.HI与H2SO3的物质的量浓度为0.6 mol·L-1
C.通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+
D.若再通入0.05molCl2,恰好能将HI和H2SO3完全氧化
【答案】C
【解析】
试题分析:已知H2SO3+I2+H2O=H2SO4+2HI,说明碘单质的氧化性强于亚硫酸,还原性亚硫酸强于HI,将0.1molCl2通入100ml含等物质的量的HI与H2SO3的混合溶液中,首先被氧化的是亚硫酸,有一半的HI被氧化,则亚硫酸完全被氧化。A.物质的还原性:H2SO3>HI> HCl,故A错误;B.设HI与H2SO3的物质的量均为x,则根据得失电子守恒有:2x+![]() =0.1mol ×2,解得x=0.08mol,HI与H2SO3的物质的量浓度为0.8mol·L-1,故B错误;C.根据上述计算,通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+,故C正确;D.若再通入0.05molCl2,氧化的HI的物质的量为
=0.1mol ×2,解得x=0.08mol,HI与H2SO3的物质的量浓度为0.8mol·L-1,故B错误;C.根据上述计算,通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+,故C正确;D.若再通入0.05molCl2,氧化的HI的物质的量为![]() =0.1mol,而溶液中占有0.04molHI,故氯气过量,故D错误;故选C。
=0.1mol,而溶液中占有0.04molHI,故氯气过量,故D错误;故选C。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1) A元素在元素周期表中的位置________;A、B、C三种元素的第一电离能由大到小的排序为_____(用元素符号填写);
(2) B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为____,B元素所形成的单质分子中σ键与π键数目之比为____。
(3) G元素的低价阳离子的离子结构示意图是________,F元素原子的外围电子排布图是________,H元素的基态原子核外电子排布式是________。
(4) D元素的单质及其常见化合物的焰色反应主要利用了原子光谱中的______(A.原子吸收光谱B.原子发射光谱)
(5) 上述元素属于p区的是_______(用元素符号填写);
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
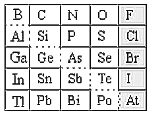
(1)元素Ga在元素周期表中的位置为:__________(写明周期和族)。
(2)Sn的最高正价为______,Cl的最高价氧化物对应水化物的化学式为_____,As的气态氢化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是_____(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_____H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O_____H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_____(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为_________。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是_____(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入_____,再加入_____,将生成气体通过_____洗气后,通入_____; | 现象:__________; 结论:非金属性C>Si |
【题目】(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
| c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
第10min | 0.7 | 1.475 | 0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1