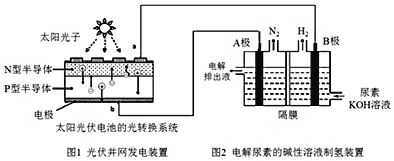
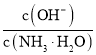题目内容
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g)反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6mol,C的物质的量为0.8 mol。
2C(g)+2D(g)反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________ mol·L-1 。
(3)10 s末,生成物D的物质的量浓度为____ mol·L-1。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”)。
【答案】0.04mol·L-1·s-1 1.5 0.4 1:1 不变
【解析】
根据题意列三段式有

所以a=(1.2+1.8)mol=3mol,b=(0.4+0.6)mol=1mol。
(1)10s内△n(C)=0.8mol,容器体积为2L,所以v(C)=![]() =0.04mol·L-1·s-1;
=0.04mol·L-1·s-1;
(2)根据分析可知反应前A的物质的量为3mol,容器体积为2L,所以A的浓度为1.5mol/L;
(3)根据分析可知10s末D的物质量为0.8mol,容器体积为2L,所以D的浓度为0.4mol/L;
(4)A的转化率为![]() ,B的转化率为
,B的转化率为![]() ,二者转化率为1:1;
,二者转化率为1:1;
(5)该反应前后气体体积系数不变,所以反应过程中气体的总物质的量不变,根据质量守恒可知气体的总质量不变,所以平均相对分子质量不变。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。