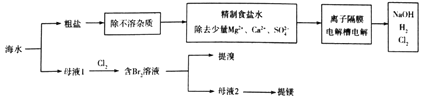
题目内容
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
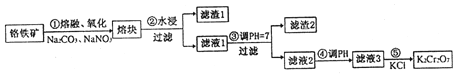
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
(2)滤渣1中含量最多的金属元素是_________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是______(用离子方程式表示)。
(4)某工厂用76 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,则产率为_______。
【答案】 7:2 不能 Fe A1(OH)3 小 2CrO42-+2H+=Cr2O72-+H2O 70%
【解析】(1) FeO·Cr2O3是还原剂,完全氧化为Na2CrO4和Fe2O3,每mol转移7mol电子,而NaNO3是氧化剂,还原产物为NaNO2,每mol转移2mol电子,根据电子守恒可知,FeO·Cr2O3和NaNO3的系数比为 7:2,烙块在高温下会与Na2CO3反应,则熔融时不能使用陶瓷容器;(2)熔块中氧化铁不溶于水,过滤后进入滤渣1,则滤渣1中含量最多的金属元素是铁,滤液1中含有AlO2-、SiO32-及CrO42-,调节溶液pH并过滤后得滤渣2为A1(OH)3;(3)滤液2调节pH的目的是提高溶液的酸性,pH变小;因为溶液中存在2CrO42-+2H+=Cr2O72-+H2O,增大溶液中H+浓度,可促进平衡正向移动,提高溶液中Cr2O72-的浓度;(4)样品中Cr2O3的质量为76 kg ×40%=30.4kg,则生成K2Cr2O7 的理论质量为30.4kg×![]() =58.8kg,则所得产品的产率为
=58.8kg,则所得产品的产率为![]() ×100%=70%。
×100%=70%。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因:______________________________。
②在NaHA水溶液中各离子浓度的大小关系是:______________________________。
(2)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K=______。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。