题目内容
常温下,关于溶液的稀释说法正确的是
- A.将1 L 0.1mol·L-1的Ba(OH)2溶液加水稀释为2L,pH=13
- B.pH=3的醋酸溶液加水稀释100倍,pH=5
- C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol·L-1
- D.pH=8的NaOH溶液加水稀释100倍,其pH=6
A
试题分析:选项A、Ba(OH)2溶液中
故其 。故A正确。
。故A正确。
选项B、对于弱酸,稀释促进酸的电离,因此稀释100后,其pH<5.
选项C、水电离产生的
选项D、pH=8的NaOH溶液加水稀释100倍,其pH应接近7,但不会小于7.
考点:电解质溶液
点评:本题主要考查溶液pH的计算,以及溶液稀释后pH的变化。
①溶液中pH的计算,应掌握其基本的计算公式: ;
;
②对于任意溶液中,均存在着公式: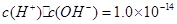 ;
;
③对于酸性溶液,水电离产生的
④对于溶液的稀释,无限稀释7为限。即酸性溶液稀释后,pH不会大于7;碱性溶液稀释后,pH不会小于7.
试题分析:选项A、Ba(OH)2溶液中

故其
 。故A正确。
。故A正确。选项B、对于弱酸,稀释促进酸的电离,因此稀释100后,其pH<5.
选项C、水电离产生的

选项D、pH=8的NaOH溶液加水稀释100倍,其pH应接近7,但不会小于7.
考点:电解质溶液
点评:本题主要考查溶液pH的计算,以及溶液稀释后pH的变化。
①溶液中pH的计算,应掌握其基本的计算公式:
 ;
;②对于任意溶液中,均存在着公式:
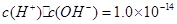 ;
;③对于酸性溶液,水电离产生的

④对于溶液的稀释,无限稀释7为限。即酸性溶液稀释后,pH不会大于7;碱性溶液稀释后,pH不会小于7.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
关于下列各图的叙述不正确的是( )
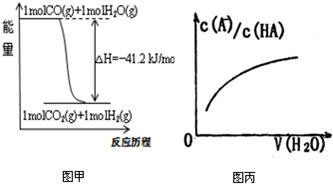
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |

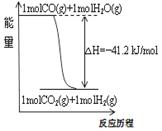
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
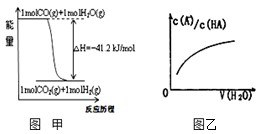 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
关于下列各图的叙述错误的是 ( )
 |

| 化学方程式 | 平衡常数K |
| F2+H2 | 6.5×1095 |
| Cl2+H2 | 2.6×1033 |
| Br2+H2 | 1.9×1019 |
| I2 + H2 | 8.7×102 |
图 甲 表 乙 图 丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
