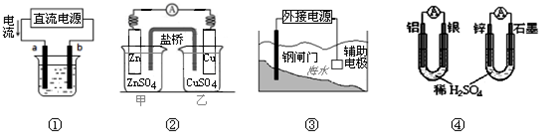
题目内容
关于下列各图的叙述不正确的是( )
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |

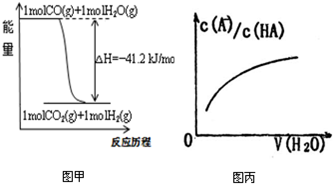
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
分析:A、依据一氧化碳燃烧热写出热化学方程式结合盖斯定律计算得到CO和H2O(g)反应的热化学方程式分析判断;
B、依据酸碱反应量计算判断;
C、K值越大,说明反应的正向程度越大,即转化率越高,;反应的正向程度越小;
D、常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,
比值增大.
B、依据酸碱反应量计算判断;
C、K值越大,说明反应的正向程度越大,即转化率越高,;反应的正向程度越小;
D、常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,
| c(A-) |
| c(HA) |
解答:解:A、CO的燃烧热283kJ/mol,热化学方程式为:①CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol;
②2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol;
依据盖斯定律①-②÷2得到CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2KJ/mol,图象符合,故A正确;
B、某温度下,pH=11的NH3?H2O氢氧根离子浓度为10-3mol/L,和pH=1的盐酸溶液中氢离子浓度为0.1mol/L;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05mol/L;依据氮元素守恒,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1,故B正确;
C、K值越大,说明反应的正向程度越大,即转化率越高,;反应的正向程度越小,说明生成物越不稳定,越易分解,反应程度越小,但不能判断与氢气反应的剧烈程度故C错误;
D、常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,
比值增大,符合图象分析,故D正确;
故选C.
| 1 |
| 2 |
②2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol;
依据盖斯定律①-②÷2得到CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2KJ/mol,图象符合,故A正确;
B、某温度下,pH=11的NH3?H2O氢氧根离子浓度为10-3mol/L,和pH=1的盐酸溶液中氢离子浓度为0.1mol/L;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05mol/L;依据氮元素守恒,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1,故B正确;
C、K值越大,说明反应的正向程度越大,即转化率越高,;反应的正向程度越小,说明生成物越不稳定,越易分解,反应程度越小,但不能判断与氢气反应的剧烈程度故C错误;
D、常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,
| c(A-) |
| c(HA) |
故选C.
点评:本题考查了热化学方程式和盖斯定律的计算应用,酸碱反应的计算分析,平衡常数的意义分析,弱电解质稀释的两种浓度大小比较,题目难度中等.

练习册系列答案
相关题目