题目内容
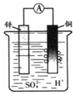
(10分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从
经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极),放电一段时间后,正极区pH值 (填变大、变小或不变)。
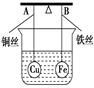
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______ 。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。
经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极),放电一段时间后,正极区pH值 (填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______ 。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。
(1)2H++2e-=H2↑ 还原 锌 铜 正极 变大
(2) Fe-2e-= Fe2+ Fe+2Fe3+=3Fe2+
(3)负极:2Fe-4e-=2Fe2+ 正极: O2+4e-+2H2O=4OH-
(2) Fe-2e-= Fe2+ Fe+2Fe3+=3Fe2+
(3)负极:2Fe-4e-=2Fe2+ 正极: O2+4e-+2H2O=4OH-
(1)在原电池中较活泼的金属作负极,失去电子被氧化,发生氧化反应。电子经过导线传递到正极是,所以溶液中的阳离子向正极移动,在正极得到电子,发生还原反应。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,此时铁是负极,失去电子被氧化而溶解。铜是正极,溶液中的铁离子得到电子,被还原生成亚铁离子。
(3) 将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,此时将发生铁的吸氧腐蚀,铁作负极。石墨作正极,溶解在溶液中的氧气得到电子。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,此时铁是负极,失去电子被氧化而溶解。铜是正极,溶液中的铁离子得到电子,被还原生成亚铁离子。
(3) 将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,此时将发生铁的吸氧腐蚀,铁作负极。石墨作正极,溶解在溶液中的氧气得到电子。

练习册系列答案
相关题目