��Ŀ����
����Ŀ��Mn��Fe��Ϊ��4���ڹ��ɽ���Ԫ�أ���Ԫ�صIJ��ֵ������������±���
Ԫ�� | Mn | Fe | |
������/(kJ��mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�ش��������⣺
��1��MnԪ�ػ�̬ԭ�Ӽ۵��Ӳ�ĵ����Ų�ʽΪ__���Ƚ���Ԫ�ص�I2��I3��֪����̬Mn2+��ʧȥһ�����ӱ���̬Fe2+��ʧȥһ�������ѣ���ԭ����__��
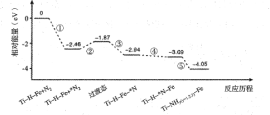
��2���������ľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ__��Feԭ����λ��֮��Ϊ__��
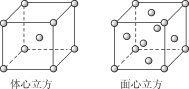
���𰸡�3d54s2 Mn2+ת��ΪMn3+ʱ��3d�ܼ��ɽ��ȶ���3d5�����״̬ת��Ϊ���ȶ���3d4״̬(��Fe2+ת��ΪFe3+ʱ��3d�ܼ��ɲ��ȶ���3d6״̬ת��Ϊ���ȶ���3d5�����״̬ 2��1 3��2
��������
(1)���ݺ�������Ų��Ĺ�����д��ԭ�ӹ�����ڰ�����ȫ����ȫ��ʱ�������ͣ����ȶ���
(2)���þ�̯�����㾧����ԭ�ӵ���Ŀ���������������У��Զ����Fe��������֮�����Feԭ��λ�������ϣ��������������������ĵ�Fe��������֮�����Feԭ�Ӵ��ڶ����ϣ��ݴ˷������
(1)MnԪ��Ϊ25��Ԫ�أ���������Ų�ʽΪ[Ar]3d54s2�����Լ۲�����Ų�ʽΪ3d54s2����Mn2+ת��ΪMn3+ʱ��3d�ܼ��ɽ��ȶ���3d5�����״̬תΪ���ȶ���3d4״̬����Ҫ�������϶ࣻ��Fe2+��Fe3+ʱ��3d�ܼ��ɲ��ȶ���3d6���ȶ���3d5�����״̬����Ҫ���������٣��ʴ�Ϊ��3d54s2��Mn2+ת��ΪMn3+ʱ��3d�ܼ��ɽ��ȶ���3d5�����״̬ת��Ϊ���ȶ���3d4״̬(��Fe2+ת��ΪFe3+ʱ��3d�ܼ��ɲ��ȶ���3d6״̬ת��Ϊ���ȶ���3d5�����״̬)��
(2)��������������ʵ�ʺ��е�Feԭ�Ӹ���Ϊ8��![]() +6��
+6��![]() =4���������������к���Feԭ�ӵĸ���Ϊ8��
=4���������������к���Feԭ�ӵĸ���Ϊ8��![]() +1=2����������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ2��1����������������ÿ��Feԭ����Χ��12��Feԭ�ӣ���������������ÿ��Feԭ����Χ��8��Feԭ�ӣ���Feԭ����λ��֮��Ϊ12��8=3��2���ʴ�Ϊ��2��1��3��2��
+1=2����������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ2��1����������������ÿ��Feԭ����Χ��12��Feԭ�ӣ���������������ÿ��Feԭ����Χ��8��Feԭ�ӣ���Feԭ����λ��֮��Ϊ12��8=3��2���ʴ�Ϊ��2��1��3��2��