题目内容
一定温度下,向容积恒定的密闭容器中投入2 mol A和1 mol B,发生如下可逆反应:2A(g)+B(g) C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )
C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )
 C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )
C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )| A.25% | B.40% | C.50% | D.75% |
A
考查可逆反应的有关计算。2A(g) + B(g)  C(g)+D(s)
C(g)+D(s)
起始量(mol) 2 1 0
转化量(mol) x 0.5x 0.5x
平衡量(mol) 2-x 1-0.5x 0.5x
在等温等容时,压强之比就是物质的量之比
所以有2-x+1-0.5x+0.5x=3×5/6
解得x=0.5
所以转化率是0.5÷2×100%=25%,答案选A。
 C(g)+D(s)
C(g)+D(s)起始量(mol) 2 1 0
转化量(mol) x 0.5x 0.5x
平衡量(mol) 2-x 1-0.5x 0.5x
在等温等容时,压强之比就是物质的量之比
所以有2-x+1-0.5x+0.5x=3×5/6
解得x=0.5
所以转化率是0.5÷2×100%=25%,答案选A。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 2HBr(g)。
2HBr(g)。 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )  2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为( )
2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为( )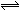 2C(g) △H>0。下列反应条件有利于生成C的是( )
2C(g) △H>0。下列反应条件有利于生成C的是( ) 2NO(g)+O2(g)。达到平衡状态的标志是( )
2NO(g)+O2(g)。达到平衡状态的标志是( ) 2SO3(g),下列操作能增大反应速率并使平衡右移的是( )
2SO3(g),下列操作能增大反应速率并使平衡右移的是( )