��Ŀ����
����Ŀ���������ں��졢DZ����ҽ�Ʒ���Ӧ�ù㷺����������[��Ҫ�ɷ�Ϊ��������(FeTiO3),������Fe2O3]Ϊԭ���Ʊ��ѵĹ���������ͼ��ʾ��
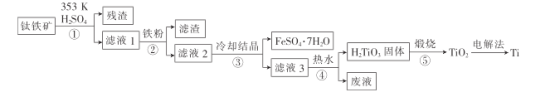
(1)����ڡ��ۡ�����,������еIJ�����_____________(���������)��
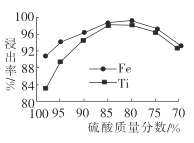
(2)��Һ1����Ԫ����TiO2+��ʽ����,�����������TiO2+�Ļ�ѧ����ʽΪ__________,���������������ѡ��������ʵ�Ӱ����ͼ��ʾ.�ݴ��ж�,���ʱ�����������������ӦΪ______(�Χ)��.
(3)�������ӷ���ʽ���Ͳ�����м���ˮ��ԭ��:__________��
(4)��ⷨ�Ʊ�Ti��װ������ʯīΪ����,TiO2Ϊ����,����CaOΪ����ʡ�Ti��_______(��������������������)���ɣ�____(������������������)������CaO����ʯ���顣
(5)���̷�Ϊԭ��,�����Ʊ���Ҫ��ҵԭ��������,������������:
![]()
���̷���Һ������Ũ���ɴ�С��˳��Ϊ__________��
��FeCO3�ﵽ�����ܽ�ƽ��ʱ,�����²����Һ��pHΪ8,c(Fe2+ )=1.0��10-5 mol��L-1������FeCO3��_____(������������������)��Fe(OH)2����֪: {Ksp[Fe(OH)2]= 4.9��10-17}
���𰸡����� FeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O 80%~85% TiO2++ 2H2O
FeSO4+TiOSO4+2H2O 80%~85% TiO2++ 2H2O![]() H2TiO3+2H+��ˮ�ⷴӦ�����ȷ�Ӧ������ˮ�ٽ���Ӧ������Ӧ������� ���� ���� c(SO42-)>c(Fe2+)>c(H+)>c(OH-) ����
H2TiO3+2H+��ˮ�ⷴӦ�����ȷ�Ӧ������ˮ�ٽ���Ӧ������Ӧ������� ���� ���� c(SO42-)>c(Fe2+)>c(H+)>c(OH-) ����
��������
����������ܽ���˵õ�����TiO2+��Fe3+����Һ������Һ�м����ۻ�ԭFe3+�����˳�ȥ����������Һ��ȴ�ᾧ�����˵õ�FeSO47H2O�ͺ���TiO2+����Һ��������ˮ�ٽ�TiO2+ˮ������H2TiO3������H2TiO3����TiO2����������Ti���Դ˽����⡣
(1)���ݷ�����֪����ڡ��ۡ����У�������еIJ����ǹ��ˣ�
(2)��Ӧ��Ϊ�������Ԫ���غ��֪����ʽΪFeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O������ͼ���֪��������������80%~85%֮��ʱ���������
FeSO4+TiOSO4+2H2O������ͼ���֪��������������80%~85%֮��ʱ���������
(3)TiO2+��ˮ��Һ�з���ˮ��TiO2++ 2H2O![]() H2TiO3+2H+��ˮ�ⷴӦ�����ȷ�Ӧ������ˮ�ٽ���Ӧ������Ӧ������У�����H2TiO3��
H2TiO3+2H+��ˮ�ⷴӦ�����ȷ�Ӧ������ˮ�ٽ���Ӧ������Ӧ������У�����H2TiO3��
(4)��TiO2����Ti��TiԪ�ػ��ϼ۽��ͷ�����ԭ��Ӧ�������������õ��ӷ�����ԭ��Ӧ��������ʯ���飬ʯ��������ˮ���������������������õ������ѣ����Բ��ܽ�����CaO����ʯ���飻
(5)���̷���Һ���������ӻᷢ��ˮ��ʹ��Һ�����ԣ�������Һ������Ũ���ɴ�СΪc(SO42-)>c(Fe2+)>c(H+)>c(OH-)��
�ڸ������⣬pHΪ8����c(OH-)=1��10-6mol/L����Ϊc(Fe2+)c2(OH-)=1.0��10-5��(1��10-6)2 =1.0��10-17��Ksp[Fe(OH)2]������Fe(OH)2���ɡ�

 �¿α�������������ҵ�������γ�����ϵ�д�
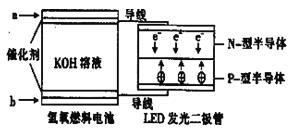
�¿α�������������ҵ�������γ�����ϵ�д�����Ŀ����a��b��c��d�ĸ������缫��GΪ�����ơ��йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������С��b���������� | ��Һ�е�SO42-��b���ƶ� | d���ܽ�c����������� | ���Ӵ�d������a�� |
�ɴ˿��ж������ֽ����Ļ��˳����
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
����Ŀ��ij��ѧ�о���ѧϰС���ijNa2CO3��NaHCO3�Ļ����Һ����ɽ���̽����ȡ20.0mL�û����Һ�������в��ϼ���1.00mol��L��1��ϡ���ᣬ����ϡ���������Ͳ����������������ʾ��
��Ӧ�� | �� | �� | �� |
ϡ�������x/mL | 0��x��10.0 | 10.0��x��40.0 | x��40.0 |
�֡����� | ������ | ������ | ������ |
������Һ��c��HCO3����Ϊ��������
A. 1.00mol��L��1 B. 0.50mol��L��1 C. 1.50mol��L��1 D. 2.00mol��L��1