题目内容
14.下列说法正确的是( )| A. | 氨水加水稀释后,溶液中所有的离子浓度都减小 | |
| B. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |
分析 A.稀释氨水的过程中,氢氧根离子浓度减小,而水的离子积不变;
B.催化剂对反应速率有影响,对平衡无影响;
C.根据△H-T△S<0反应自发进行判断;
D.C6H5OH的酸性强于HCO3-.
解答 解:A.加水稀释能促进氨水电离,但氨水电离的量远远小于水增加的量,所以NH3•H2O、NH4+、OH-浓度都降低,C(H+)=$\frac{Kw}{c(O{H}^{-})}$增大,故A错误;
B.催化剂对反应速率有影响,能加快反应速率,但是催化剂对化学平衡无影响,即对平衡转化率无影响,故B错误;
C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,说明△H-T△S<0,已知该反应△S<0,所以该反应的△H<0,故C正确;
D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于HCO3-,故D错误.
故选C.
点评 本题考查了电离平衡的移动、催化剂对速率和平衡的影响、反应自发性的判断等,题目难度中等,明确影响速率和平衡移动的因素即可解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.设NA阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g由O2和O3组成的混合气体所含电子数8NA | |
| B. | 实验室分别用KClO3和H2O2制取3.2gO2时,转移的电子数均为0.4NA | |
| C. | 25℃时,1L PH=1的稀硫酸中约2NA个H+ | |
| D. | 标准状况下,22.4L SO3所含分子数NA |
5.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
2.下列元素属于海水中的常量元素的是( )
①H ②O ③Na ④Cl ⑤Li ⑥U ⑦Ca ⑧K ⑨Br ⑩F.
①H ②O ③Na ④Cl ⑤Li ⑥U ⑦Ca ⑧K ⑨Br ⑩F.
| A. | ①②③④⑦⑧⑨⑩ | B. | ③④⑦⑧⑨⑩ | C. | ①②③④⑥⑦⑧⑨⑩ | D. | ③④⑥⑦⑧⑨⑩ |
9.下殂关化学用语表示正确的是( )
| A. | 葡萄糖的结构简式:C6H12O6 | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 甲烷分子的比例模型: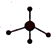 | D. | Cl-的结构示意图: |
19.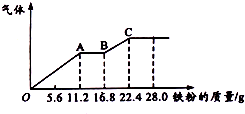 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )| A. | H2SO4浓度为5mol•L-1 | |
| B. | 第二份溶液中最终溶质为FeSO4 | |
| C. | 每份混合酸中NO3-物质的量为0.2mol | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
6.关于吸热反应和放热反应,下列说法中错误的是( )
| A. | A、需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应中的能量变化除了热量外还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化服从能量守恒定律 | |
| D. | 生成物的总能量小于反应物的总能量时发生的是放热反应 |
4.利用废铜屑制取CuSO4溶液的最好的方法是( )
| A. | 铜屑与浓硫酸混合加热 | |
| B. | 铜屑在空气中灼烧后再溶于稀H2SO4 | |
| C. | 铜屑与稀硫酸混合加热 | |
| D. | 铜屑在空气中灼烧后再溶于浓H2SO4 |