题目内容
工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2?12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):Al2O3+3H2SO4→Al2(SO4)3+3H2O…①
Al2(SO4)3+H2SO4+2NH3→2NH4Al(SO4)2 …②
(1)制取1000g铵明矾,需消耗氨气______L(标准状况);
(2)以1000Kg含氧化铝36%的高岭土为原料制取硫酸铝,需消耗质量分数98%的硫酸(密度1.84g/cm3)______L;
(3)某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.
①若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,计算投料时氧化铝和硫酸的物质的量之比.
②以含a mol氧化铝的高岭土为原料,设制得的产物中硫酸铝的物质的量分数为x,试导出消耗硫酸的物质的量y与a、x的函数关系.
【答案】分析:(1)根据反应的方程式计算消耗氨气的体积;
(2)根据反应方程式计算需要硫酸的质量,进而可计算溶液的体积;
(3)根据质量守恒定律列式计算①②.
解答:解:(1)n(NH4Al(SO4)2?12H2O)=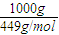 =2.23mol,
=2.23mol,
Al2(SO4)3+H2SO4+2NH3═2NH4Al(SO4)2
44.8L 2mol
V 2.23mol
V=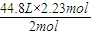 =49.95L,故答案为:49.95L;
=49.95L,故答案为:49.95L;
(2)m(Al2O3)=1000Kg×36%=360Kg,
Al2O3+3H2SO4→Al2(SO4)3+3H2O
102g 294g
360Kg m(H2SO4)
m(H2SO4)=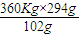 =1037.6Kg,
=1037.6Kg,
需消耗质量分数98%的硫酸为:
V= =575.4L,
=575.4L,
故答案为:575.4L;
(3)①设制备的[NH4Al(SO4)2?12H2O和Al2(SO4)3的物质的量的物质的量各为1mol,从质量守恒的角度分析,则
n(Al)=1mol+2mol=3mol,n(SO42-)=2mol+3mol=5mol,
所以:n(Al2O3)=1.5mol,
n(H2SO4)=5mol,
n(Al2O3):n(H2SO4)=1.5mol:5mol=3:10,
答:投料时氧化铝和硫酸的物质的量之比为3:10;
②设产物中含有mmolNH4Al(SO4)2?12H2O,nmolAl2(SO4)3,
则:
解之得: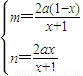
y=2m+3n=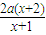 ,
,
答:消耗硫酸的物质的量y与a、x的函数关系为y=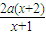 .
.
点评:本题考查化学方程式的计算,题目难度中等,本题注意从质量守恒的角度解答.
(2)根据反应方程式计算需要硫酸的质量,进而可计算溶液的体积;
(3)根据质量守恒定律列式计算①②.
解答:解:(1)n(NH4Al(SO4)2?12H2O)=
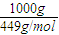 =2.23mol,
=2.23mol,Al2(SO4)3+H2SO4+2NH3═2NH4Al(SO4)2
44.8L 2mol
V 2.23mol
V=
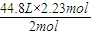 =49.95L,故答案为:49.95L;
=49.95L,故答案为:49.95L;(2)m(Al2O3)=1000Kg×36%=360Kg,
Al2O3+3H2SO4→Al2(SO4)3+3H2O
102g 294g
360Kg m(H2SO4)
m(H2SO4)=
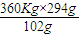 =1037.6Kg,
=1037.6Kg,需消耗质量分数98%的硫酸为:
V=
 =575.4L,
=575.4L,故答案为:575.4L;
(3)①设制备的[NH4Al(SO4)2?12H2O和Al2(SO4)3的物质的量的物质的量各为1mol,从质量守恒的角度分析,则
n(Al)=1mol+2mol=3mol,n(SO42-)=2mol+3mol=5mol,
所以:n(Al2O3)=1.5mol,
n(H2SO4)=5mol,
n(Al2O3):n(H2SO4)=1.5mol:5mol=3:10,
答:投料时氧化铝和硫酸的物质的量之比为3:10;
②设产物中含有mmolNH4Al(SO4)2?12H2O,nmolAl2(SO4)3,
则:

解之得:
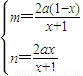
y=2m+3n=
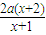 ,
,答:消耗硫酸的物质的量y与a、x的函数关系为y=
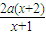 .
.点评:本题考查化学方程式的计算,题目难度中等,本题注意从质量守恒的角度解答.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目