题目内容
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是
①标况下2.24L己烷中,含1.4NA个C-H键
②常温常压下,16gO2和O3混合气体中,电子数为8NA
③过氧化钠与水反应,产生3.2g氧气,则电子转移数目为0.2NA
④0.1mol/LKAl(SO4)2溶液中含Al3+数目小于0.1NA
⑤将0.1molFeCl3配成氢氧化铁胶体,胶体粒子数目最多可达到0.1NA
⑥将2.8gN2与足量氢气充分反应,得到氨气分子数目少于0.2NA
A. ①②④⑥ B. ③④⑤⑥
C. ②③⑥ D. ②③④
【答案】C
【解析】①标准状况下,己烷不是气体,2.24L己烷物质的量不是0.1mol,故①错误;②16gO2和O3混合气体含O物质的量为1mol,故电子数为8NA,②正确;③过氧化钠与水反应为Na2O2中氧元素的歧化反应, ,生成1molO2转移2mol电子,所以生成3.2g氧气(0.1mol),则电子转移数目为0.2NA,故③正确;④溶液体积未知,无法计算Al3+数目,故④错误;⑤胶体粒子是Fe(OH)3微粒的集合体,故0.1molFeCl3最多生成0.1NA个Fe(OH)3微粒,胶体粒子数目小于0.1NA,⑤错误;⑥若2.8gN2(0.1mol)完全反应,则得到氨气分子数目等于0.2NA,因为该反应为可逆反应,故得到氨气分子数目少于0.2NA,⑥正确。综上,②③⑥正确,选C。
,生成1molO2转移2mol电子,所以生成3.2g氧气(0.1mol),则电子转移数目为0.2NA,故③正确;④溶液体积未知,无法计算Al3+数目,故④错误;⑤胶体粒子是Fe(OH)3微粒的集合体,故0.1molFeCl3最多生成0.1NA个Fe(OH)3微粒,胶体粒子数目小于0.1NA,⑤错误;⑥若2.8gN2(0.1mol)完全反应,则得到氨气分子数目等于0.2NA,因为该反应为可逆反应,故得到氨气分子数目少于0.2NA,⑥正确。综上,②③⑥正确,选C。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
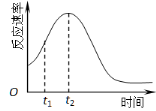 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。




