题目内容
【题目】氯酸钾和浓盐酸之间有下列反应:2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)该反应中发生还原反应的物质是__________。氧化产物是___________。
(2)用双线桥标出方程式中的电子得失___________。
2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)当有0.2mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
【答案】 KClO3 Cl2 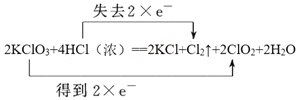 2.24 0.2 ②
2.24 0.2 ②
【解析】(1)氯酸钾中氯元素化合价从+5价降低到+4价,得到1个电子,因此该反应中发生还原反应的物质是KClO3。氯化氢中氯元素化合价从-1价升高到0价,失去电子,则氧化产物是Cl2。(2)根据以上分析可知用双线桥标出方程式中的电子得失为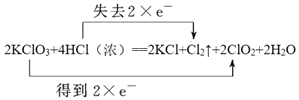 。(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol,在标准状况下的体积为2.24L。根据氯原子守恒可知被氧化的HCl的物质的量为0.2mol。(4)假设均是1mol氧化剂参加反应,根据电子得失守恒可知1mol高锰酸钾得到氯气的物质的量是2.5mol,1mol二氧化锰得到氯气的物质的量是1mol,根据方程式Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O可知1mol次氯酸钙得到2mol氯气,所以生成氯气的物质的量最少的是二氧化锰,答案选②。
。(3)当有0.2mol电子发生转移时,生成的氯气是0.1mol,在标准状况下的体积为2.24L。根据氯原子守恒可知被氧化的HCl的物质的量为0.2mol。(4)假设均是1mol氧化剂参加反应,根据电子得失守恒可知1mol高锰酸钾得到氯气的物质的量是2.5mol,1mol二氧化锰得到氯气的物质的量是1mol,根据方程式Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O可知1mol次氯酸钙得到2mol氯气,所以生成氯气的物质的量最少的是二氧化锰,答案选②。

 名校课堂系列答案
名校课堂系列答案

