题目内容
16.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )| A. | HN3水溶液中微粒浓度大小顺序为:c(H+)>c( N3-)>c(HN3)>c(OH-) | |
| B. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c( N3-)>c(OH-)>c(H+) | |
| C. | HN3与NH3作用生成的叠氮酸铵是强电解质 | |
| D. | N3-与CO2互为等电子体 |
分析 叠氮酸(HN3)与醋酸酸性相似,应为弱酸,
A.HN3水溶液呈弱酸性,根据电离特征比较离子浓度大小;
B.NaN3水溶液呈碱性,N3-水解;
C.HN3与NH3作用生成的叠氮酸铵为强电解质;
D.根据等电子体的概念及二者结构分析.
解答 解:A.HN3为弱酸,不能完全电离,电离程度较小,则有c(HN3)>c(H+),溶液呈酸性,则有c(H+)>c(OH-),溶液中还存在水的电离,则有c(H+)>c(N3-),溶液中粒子浓度大小为:c(HN3)>c(H+)>c(N3-)>c(OH-),故A错误;
B.叠氮酸(HN3)与醋酸酸性相似,醋酸钠溶液呈碱性,则NaN3水溶液呈碱性,存在c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.HN3与NH3作用生成的叠氮酸铵属于铵盐,为强电解质,故C正确;
D.N3-含有电子数为3×7+1=22,CO2含有电子数为6+2×8=22,二者含相等电子数,故D正确;
故选A.
点评 本题考查离子浓度的大小比较,题目难度中等,明确题给信息的含义为解答该题的关键,易错点为A,注意不能忽视水的电离,试题培养了学生的分析能力及知识迁移能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 少量稀HNO3中加入足量铁粉:Fe+4H++NO3-═NO↑+Fe3++2H2O | |
| B. | 以石墨作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | NH4HCO3溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
7.下列说法不正确的是( )
| A. | 玉米芯、甘蔗渣等在稀硫酸作用下水解所得的木糖C5H10O5,属于多羟基醛,木糖与浓硫酸加热作用可生成糠醛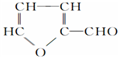 ,由木糖生成糠醛的反应有消去反应 ,由木糖生成糠醛的反应有消去反应 | |
| B. | 醛类、葡萄糖、甲酸及其甲酸酯类均能发生银镜反应 | |
| C. | 阿斯巴甜是目前使用最广泛的甜味剂,其结构简式为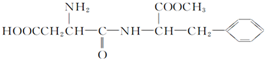 它既能与酸反应又能与碱反应,是一种常见的氨基酸 它既能与酸反应又能与碱反应,是一种常见的氨基酸 | |
| D. | BAD是一种紫外线吸收剂,它的结构简式如下: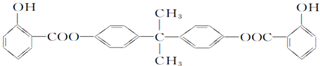 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 |
11.下列是氧化还原反应也是吸热反应的是( )
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
1.下列说法中正确的是( )
| A. | 胶体区别于其它分散系的本质特性是丁达尔现象 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 加入电解质,胶体一定能发生凝聚 |
5.萘环上的碳原子的编号如(I)式,根据系统命名法,(II)式可称为2一硝基萘,则化合物 (III)的名称应是( )


| A. | 2,6一二甲基萘 | B. | 2,5一二甲基萘 | C. | 4,7一二甲基萘 | D. | 1,6一二甲基萘 |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1 NA | |
| D. | 235 g核素${\;}_{92}^{239}$U发生裂变反应:${\;}_{92}^{239}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.