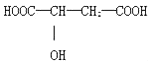��Ŀ����
����Ŀ��W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�Ԫ��X��ԭ�����������������ڲ��3����Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Y��X��Z����ͬһ���ڣ���Yԭ�Ӻ���p���ӱ�s���Ӷ�5����
(1)Z��̬ԭ�ӵĺ�������Ų�ʽΪ__________��
(2)Z����������ʯ�ͻ�������Ҫ�Ĵ���֮һ����������(![]() )�ѻ����ɱ��ͱ�ϩ��
)�ѻ����ɱ��ͱ�ϩ��
��1mol��ϩ�����к��ЦҼ���м���Ŀ֮��Ϊ_______��
�ڱ�������̼ԭ�ӹ�����ӻ�����Ϊ__________��
��Z��һ��������ZO5�У�Z�Ļ��ϼ�Ϊ+6�������й���������ĿΪ_______����
(3)W��X��Y����Ԫ�صĵ縺����С����˳��Ϊ__________��(����Ԫ�ط��Żش�)
(4)ZY3�۵�Ϊ1152�棬����״̬���ܹ����磬�ݴ˿��ж�ZY3��������__________(�������)��
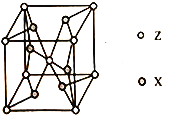
(5)ZX2����ľ����ṹ��ͼ��ÿ��Zԭ����Χ�����X ԭ����ĿΪ__________�����û��������Է�������ΪM�������߳�Ϊacm�������ӵ�����ΪNA����þ�����ܶ�Ϊ_________g/cm3��
���𰸡� [Ar]3d54s1 8:1 sp2 2 H<Cl<O ���Ӿ��� 6 ![]()
��������W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�W��H��Ԫ��X��ԭ�����������������ڲ��3����X��O��Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Z��Cr��Y��X��Z����ͬһ���ڣ�Y�ǵ�������Ԫ�أ�Yԭ�Ӻ���p���ӱ�s���Ӷ�5����Y��Cl��
(1)Cr��̬ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d54s1��(2)�ٵ�������������˫���к���1��������1������������1mol��ϩ���ӣ�CH2��CHCH3���к���������������Ŀ֮��Ϊ8:1���ڱ�������ƽ���νṹ��������̼ԭ�ӹ�����ӻ�����Ϊsp2���������������ĿΪx����2����ԭ�ӵĸ�����5��2x��Cr�Ļ��ϼ�Ϊ+6������������۴�����Ϊ0��֪2x+(5��2x)��2��6�����x��2��(3)�ǽ�����Խǿ���縺��Խ����W��X��Y����Ԫ�صĵ縺����С����˳��ΪH��Cl��O��(4)CrCl3�۵�Ϊ1152�棬����״̬���ܹ����磬�ݴ˿��ж�CrCl3�����������Ӿ��塣(5)���ݾ����ṹ���ж�ÿ��Crԭ����Χ�����Oԭ����ĿΪ6����������Cr��1��8��1/8��2������þ�����ܶ�Ϊ g/cm3��
g/cm3��

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�