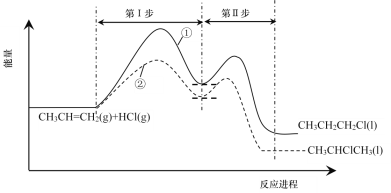
题目内容
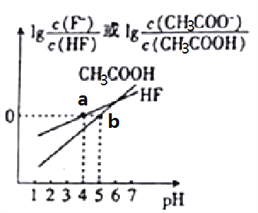
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是( )
A. 将0.2molL-1CH3COOH溶液和0.1molL-1NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH)
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH大于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液![]()
【答案】C
【解析】A. 0.2molL-1CH3COOH溶液和0.1molL-1NaOH溶液等体积混合后的溶液中存在等浓度的醋酸钠和醋酸,根据电荷守恒,c(OH-)+c(CH3COO-)=c(H+)+ c(Na+),根据物料守恒,c(CH3COO-)+c(CH3COOH)=2 c(Na+),根据上述2式有2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH),故A正确;B.根据图像,a点时,lg =0,则c(F-)=c(HF),溶液的pH=4,则c(H+)>c(OH-),此时溶液中含有NaF和HF,根据电荷守恒,c(F-)+ c(OH-)=c(Na+)+c(H+),则c(F-)>c(Na+),因此c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),故B正确;C. 根据图像,当lg
=0,则c(F-)=c(HF),溶液的pH=4,则c(H+)>c(OH-),此时溶液中含有NaF和HF,根据电荷守恒,c(F-)+ c(OH-)=c(Na+)+c(H+),则c(F-)>c(Na+),因此c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),故B正确;C. 根据图像,当lg =lg
=lg![]() =0,有K(HF)=
=0,有K(HF)=  = c(H+)=10-4,同理K(CH3COOH)=10-5,因此酸性HF>CH3COOH,则0.1mol/LNaF溶液的pH<0.1mol/LCH3COONa溶液的pH,故C错误;D. 根据图像,向CH3COOH溶液中加入NaOH溶液后所得的混合溶液10(pH-pKa)=
= c(H+)=10-4,同理K(CH3COOH)=10-5,因此酸性HF>CH3COOH,则0.1mol/LNaF溶液的pH<0.1mol/LCH3COONa溶液的pH,故C错误;D. 根据图像,向CH3COOH溶液中加入NaOH溶液后所得的混合溶液10(pH-pKa)= ![]() =
=![]() =
=![]() =
=![]() ,故D正确;故选C。
,故D正确;故选C。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

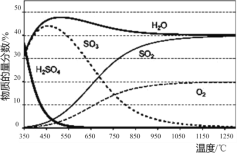
(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
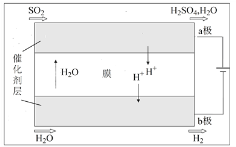
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023