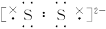题目内容
X、Y、Z、W都是短周期元素,原子半径为W>Z>X>Y。已知:X、Y两元素处于同一周期,X、Z处于周一主族,Z原子核内的质子数等于X、Y原子核内的质子数之和;Z原子最外电子层上的电子数是W原子最外电子层上的电子数的4倍。试回答:
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式) 。
(2)由这四种元素组成的两种正盐的水溶液(均为0.1 mol·L-1)的pH由大到小的顺序是(写化学式) 。
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中原子均换成Z原子,再在原两个Z原子连线的中点位置放一个Y原子,则此晶体中由Z、Y原子组成的最小环是 元环,在此最小环上有 个Y原子和 个Z原子。
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式) 。
(2)由这四种元素组成的两种正盐的水溶液(均为0.1 mol·L-1)的pH由大到小的顺序是(写化学式) 。
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中原子均换成Z原子,再在原两个Z原子连线的中点位置放一个Y原子,则此晶体中由Z、Y原子组成的最小环是 元环,在此最小环上有 个Y原子和 个Z原子。
(1)金刚石(C)>Si>Na>O2
(2)Na2SiO3>Na2CO3
(3)12 6 6
(2)Na2SiO3>Na2CO3
(3)12 6 6
(1)因为X、Y、Z、W都是短周期元素,所以均处于前三周期。又因为同周期元素的原子半径从左到右逐渐减小,X、Y两元素处于同一周期,原子半径X>Y,说明X元素在Y元素的左边,而同一主族元素的原子半径从上到下逐渐增大。X、Z处于同一主族,原子半径Z>X,说明Z在X的下边。对于原子半径W>Z,说明W与Z同周期且位于Z的左边(W处于Z的下一周期在本题中不可能),它们的相对位置如图:
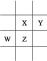
根据Z原子核内质子数等于X、Y原子核内质子数之和可知:Z原子核内质子数-X原子核内质子数=Y原子核内质子数,而Z、X相差8个核电荷(本题中相差2个核电荷不可能),故Y中有8个质子,为O元素;根据Z原子最外电子层上的电子数是W原子最外电子层上的电子数的4倍,若W最外层为1个电子,则Z为ⅣA族Si元素,若W最外层为2个电子,则Z最外层有8个电子,为Ar元素,不可能。
金刚石和晶体硅均为原子晶体,其熔点很高,金属钠为金属晶体,熔点较高,而O2形成的晶体为分子晶体,熔点最低,对于金刚石和晶体硅而言,其熔点高低取决于它们的共价键的强弱。
(2)硅酸比碳酸的酸性更弱(同主族元素从上到下其最高价氧化物对应水化物的酸性减弱),故Na2SiO3的水解程度大些。
(3)因为在金刚石结构中,最小的碳环为6元环,根据题意,SiO2最小环应为12元环,其中Si与O交替相连,故Si原子与O原子相等,都为6个。

根据Z原子核内质子数等于X、Y原子核内质子数之和可知:Z原子核内质子数-X原子核内质子数=Y原子核内质子数,而Z、X相差8个核电荷(本题中相差2个核电荷不可能),故Y中有8个质子,为O元素;根据Z原子最外电子层上的电子数是W原子最外电子层上的电子数的4倍,若W最外层为1个电子,则Z为ⅣA族Si元素,若W最外层为2个电子,则Z最外层有8个电子,为Ar元素,不可能。
金刚石和晶体硅均为原子晶体,其熔点很高,金属钠为金属晶体,熔点较高,而O2形成的晶体为分子晶体,熔点最低,对于金刚石和晶体硅而言,其熔点高低取决于它们的共价键的强弱。
(2)硅酸比碳酸的酸性更弱(同主族元素从上到下其最高价氧化物对应水化物的酸性减弱),故Na2SiO3的水解程度大些。
(3)因为在金刚石结构中,最小的碳环为6元环,根据题意,SiO2最小环应为12元环,其中Si与O交替相连,故Si原子与O原子相等,都为6个。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
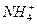 与NH3所含的质子数、核外电子数的关系描述正确的是( )
与NH3所含的质子数、核外电子数的关系描述正确的是( )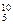 B、
B、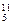 B,硼元素的近似相对原子质量为10.80,则对硼元素中
B,硼元素的近似相对原子质量为10.80,则对硼元素中