题目内容
X、Y、Z、W、R5种主族元素属3个短周期,且原子半径依次减小.X、R同主族不相邻,可行形成离子化合物XR;Y、Z同主族,Y元素原子的最外层电子数是其电子层数的2倍,关于上述各元素及其化合物的下列叙述不正确的是( )
| A、非金属性:Y<Z<W |
| B、Z、R按原子数1:1形成的化合物不稳定,易分解 |
| C、X分别与Y、Z、W、R形成的二元化合物,溶于水所得溶液有的呈中性,有的呈碱性 |
| D、元素Z、W按原子数1:2形成的化合物中各原子均为最外层8电子稳定结构 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、R5种主族元素属3个短周期,且原子半径依次减小,则R为H元素,X、R同主族不相邻,可行形成离子化合物XR,则X为Na,Y、Z同主族,Y原子半径较大,处于第三周期,Y元素原子的最外层电子数是其电子层数的2倍,其最外层电子数为6,故Y为S元素、Z为O元素,W原子半径小于O,可推知W为F元素,据此解答.
解答:
解:X、Y、Z、W、R5种主族元素属3个短周期,且原子半径依次减小,则R为H元素,X、R同主族不相邻,可行形成离子化合物XR,则X为Na,Y、Z同主族,Y原子半径较大,处于第三周期,Y元素原子的最外层电子数是其电子层数的2倍,其最外层电子数为6,故Y为S元素、Z为O元素,W原子半径小于O,可推知W为F元素,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性:S<O<F,故A正确;
B.Z、R按原子数1:1形成的化合物为H2O2,H2O2不稳定,易分解,故B正确;
C.H分别与S、F形成的二元化合物,溶于水所得溶液呈酸性,故C错误;
D.元素O、F按原子数1:2形成的化合物为OF2,分子各原子化合价绝对值与原子最外层电子数之和都等于8,各原子均为最外层8电子稳定结构,故D正确,
故选C.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性:S<O<F,故A正确;
B.Z、R按原子数1:1形成的化合物为H2O2,H2O2不稳定,易分解,故B正确;
C.H分别与S、F形成的二元化合物,溶于水所得溶液呈酸性,故C错误;
D.元素O、F按原子数1:2形成的化合物为OF2,分子各原子化合价绝对值与原子最外层电子数之和都等于8,各原子均为最外层8电子稳定结构,故D正确,
故选C.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意D选项中8电子结构判断.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
下列金属的冶炼要用电解法的是( )
| A、K | B、Ag | C、Fe | D、Cu |
下列有关胶体的说法不正确的是( )
| A、向Fe(OH)3胶体中滴加过量的稀硫酸,会产生红褐色沉淀 |
| B、葡萄糖注射液不能产生丁达尔现象,不属于胶体 |
| C、向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
| D、在水泥和冶金工厂常用高压电除去大量烟尘,以减少对空气的污染化学在生产和日 |
下列说法正确的是( )
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去氯气中少量的氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、将AgNO3溶液滴入某溶液中,若出现沉淀,则说明溶液中含有Cl- |
| D、将氯水滴入碳酸钠溶液中,无明显现象出现 |
下列说法错误的是( )
| A、稀有气体的原子核外电子排布都是稳定结构 |
| B、让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路” |
| C、工业上用氮气和氢气合成氨气属于人工固氮过程 |
| D、硅是应用广泛的半导体材料,常温下化学性质活泼 |
下列各项反应对应的图象错误的是( )
A、 将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
B、 将稀盐酸逐滴加入一定量偏铝酸钠溶液中 |
C、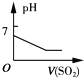 将二氧化硫逐渐通入一定量氯水中 |
D、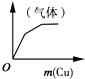 将铜粉逐渐加入一定量浓硝酸中 |
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是( )
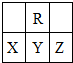

| A、原子半径大小:X>Y>Z |
| B、氢化物的稳定性:X>Y |
| C、化合物YR2能使品红溶液褪色 |
| D、X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z |