题目内容
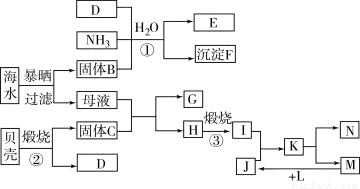
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)=2.0 × 10-5 mol·L-1)。
(1) 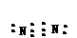 ;N2(g)+3H2 (g)
;N2(g)+3H2 (g)  2NH3 (g) △H=-34a kJ/mol
2NH3 (g) △H=-34a kJ/mol
(2)4NH3 + 5O2  4 NO +6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
4 NO +6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
(3)用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。(其他合理答案也可)
(4)NH4++ H2O  NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1
NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1
【解析】
试题分析:(1)在氮气分子中两个N原子共用三对电子,所以N2的电子式是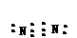 ;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)
;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)  2NH3 (g) △H=-34a kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2
2NH3 (g) △H=-34a kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2  4 NO +6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O
4 NO +6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O  NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)=2.0 × 10-5 mol/L,即
NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)=2.0 × 10-5 mol/L,即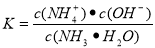 ,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5 mol/L= x/200y mol/L。
,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5 mol/L= x/200y mol/L。
考点:考查物质的电子式、方程式、热化学方程式的书写、外界条件的选择、氨气的检验、弱电解质的浓度的计算的知识。

下列实验能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 室温下,测定等浓度的CH3COOH溶液和盐酸的pH | 比较两种酸的酸性强弱 |
B | CH3CH2Br 中加入NaOH溶液加热充分反应,取上层水溶液加入AgNO3溶液 | 检验CH3CH2Br中的溴原子 |
C | 向25ml沸水中滴加4—5滴饱和FeCl3溶液,加热至有红褐色沉淀产生 | 制备Fe(OH)3胶体 |
D | 在某溶液中先加入HNO3溶液,再加入Ba(NO3)2溶液 | 检验溶液中是否存在SO42- |
利用已有的实验器材,规格和数量不限,能完成相应实验的是
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.500mol/L的溶液 |