题目内容
短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.
(l) X、Z、W形成的化合物中含有的化学键类型为______;
(2)A是由Y、Z、W三元素共同构成的常见化合物,其水溶液呈碱性,用离子方程式表示其原因______.写出表示溶液中所有离子浓度关系的等式______
(3)已知①M-M→2M△H=+a kJ?mol-1 ②2X?→X-X△H=-b kJ?mol-1
③M?+X?→XM△H=-c kJ?mol-1写出298K时,X2与M2反应的热化学方程式______
(4)若在密闭容器中充有10mol YZ与20mol X2,在催化剂作用下反应生成甲醇,YZ的转化率(α)与温度、压强的关系如图所示
①Pl______ P2(填“大于”、“小于”或“等于”)
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=______
③若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”)
④在不改变反应物用量情况下,为提高YZ转化率可采取的措施是______(答出两点即可)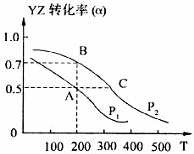
(l) X、Z、W形成的化合物中含有的化学键类型为______;
(2)A是由Y、Z、W三元素共同构成的常见化合物,其水溶液呈碱性,用离子方程式表示其原因______.写出表示溶液中所有离子浓度关系的等式______
(3)已知①M-M→2M△H=+a kJ?mol-1 ②2X?→X-X△H=-b kJ?mol-1
③M?+X?→XM△H=-c kJ?mol-1写出298K时,X2与M2反应的热化学方程式______
(4)若在密闭容器中充有10mol YZ与20mol X2,在催化剂作用下反应生成甲醇,YZ的转化率(α)与温度、压强的关系如图所示
①Pl______ P2(填“大于”、“小于”或“等于”)
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=______
③若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”)
④在不改变反应物用量情况下,为提高YZ转化率可采取的措施是______(答出两点即可)

短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,故X为H,Y是形成化合物种类最多的元素,故Y为C,Z是自然界含量最多的元素,故Z为O,W是同周期中金属性最强的元素,故W为Na,M的负一价离子与Z的某种氢化物分子(应为H2O2)含有相同的电子数即18个,故M为Cl,
(1)X、Z、W形成的化合物为NaOH,其中含有的化学键类型为离子键和共价键,故答案为:离子键、共价键;
(2)由Y、Z、W三元素共同构成的化合物为碳酸钠,CO32-水解显碱性,方程式为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-,溶液中各个离子浓度的关系遵循电荷守恒,即c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-),故答案为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-;c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-);
(3)根据盖斯定律,H2与Cl2的反应和①②③之间的关系为①-②+2×③,故反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1,故答案为:H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1;
(4)①根据图示,当温度相等时的A、B两点,看出P2时CO的转化率高于P1,而压强增大,才可以达到这种结果,故P2高于P1,故答案为:小于;
②从图中看出A点时,CO的转化率为0.5,CO+2H2
CH4O,CO的初始浓度为1mol/l,氢气的初始浓度为2mol/l,则CO变化浓度为0.5mol/l,氢气减少的浓度为1mol/l,故平衡时CO、H2、甲醇的浓度分别为0.5mol/l、1mol/l、0.5mol/l,据K=
=
=1(mol/l)-2,故答案为:1(mol/l)-2;
③因P2高于P1,故C点压强大于A点,压强大反应速率快,故反应开始到达平衡状态所需的时间tA大于tC,故答案为:大于;
④提高CO转化率,说明平衡向右移动,根据化学平衡移动的影响因素,故可以降温、加压、及时的移走甲醇等,故答案为:降温、加压.
(1)X、Z、W形成的化合物为NaOH,其中含有的化学键类型为离子键和共价键,故答案为:离子键、共价键;
(2)由Y、Z、W三元素共同构成的化合物为碳酸钠,CO32-水解显碱性,方程式为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-,溶液中各个离子浓度的关系遵循电荷守恒,即c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-),故答案为:CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-;c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-);
(3)根据盖斯定律,H2与Cl2的反应和①②③之间的关系为①-②+2×③,故反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1,故答案为:H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1;
(4)①根据图示,当温度相等时的A、B两点,看出P2时CO的转化率高于P1,而压强增大,才可以达到这种结果,故P2高于P1,故答案为:小于;
②从图中看出A点时,CO的转化率为0.5,CO+2H2
| 催化剂 |
| [CH4O] |
| [CO][H2]2 |
| 0.5 |
| 0.5×1 |
③因P2高于P1,故C点压强大于A点,压强大反应速率快,故反应开始到达平衡状态所需的时间tA大于tC,故答案为:大于;
④提高CO转化率,说明平衡向右移动,根据化学平衡移动的影响因素,故可以降温、加压、及时的移走甲醇等,故答案为:降温、加压.

练习册系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )