��Ŀ����
��Դ����������������ٵ��ش���⣬�״���δ����Ҫ����Դ����֮һ��
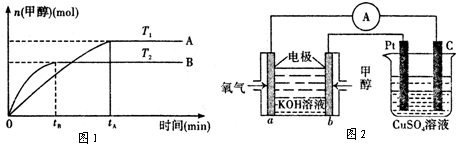
��1���ϳɼ״��ķ�ӦΪ��CO��g��+2H2��g��CH3OH��g����ͼ1��ʾij�κϳ�ʵ������м״�����������գ�CH3OH���뷴Ӧ�¶ȵĹ�ϵ���ߣ���÷�Ӧ�ġ�H
��2������230��ʱ��ƽ�ⳣ��K=1���������������䣬���¶����ߵ�500��ʱ���ﵽƽ��ʱ��K
��3����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2���ﵽƽ��ʱCO��ת����Ϊ90%����ʱ�����ڵ�ѹǿΪ��ʼʱ��
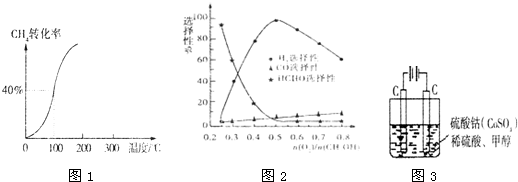
��4�����ü״�ȼ�ϵ�������ͼ2��ʾ��װ�ã�
�����װ����bΪ
�ڵ�ͭƬ�������仯Ϊ12.8gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ
��5����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ������һ�ּ����ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
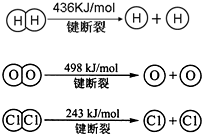
2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H=+1411.0kJ/mol
2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H=+1366.8kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽ
��1���ϳɼ״��ķ�ӦΪ��CO��g��+2H2��g��CH3OH��g����ͼ1��ʾij�κϳ�ʵ������м״�����������գ�CH3OH���뷴Ӧ�¶ȵĹ�ϵ���ߣ���÷�Ӧ�ġ�H
��
��
0�������������=����ͬ����2������230��ʱ��ƽ�ⳣ��K=1���������������䣬���¶����ߵ�500��ʱ���ﵽƽ��ʱ��K
��
��
1����3����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2���ﵽƽ��ʱCO��ת����Ϊ90%����ʱ�����ڵ�ѹǿΪ��ʼʱ��
0.55
0.55
������4�����ü״�ȼ�ϵ�������ͼ2��ʾ��װ�ã�
�����װ����bΪ
��
��
����д��װ���е����ڷ�����Ӧ�����ӷ���ʽп����Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+
���Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+
���ڵ�ͭƬ�������仯Ϊ12.8gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ
2.24
2.24
L����5����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ������һ�ּ����ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H=+1411.0kJ/mol
2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H=+1366.8kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽ
C2H4��g��+H2O��l���TC2H5OH����H=-44.2kJ/mol
C2H4��g��+H2O��l���TC2H5OH����H=-44.2kJ/mol
��
��������1�������¶ȶԻ�ѧƽ���Ӱ�����жϷ�Ӧ�������������
��2�����ڷ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�ⳣ��ԽС��
��3�����ݻ�ѧ��Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�������㣻
��4������ͼ��֪�״�ȼ�ϵ���ǵ�Դ�����ձ��е�װ��Ϊ���أ����õ��غ�ԭ������������
�ڸ��ݵ����غ���м��㣻
��5�����ݸ�˹���������㷴Ӧ���ʱ䲢��д�Ȼ�ѧ����ʽ��
��2�����ڷ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�ⳣ��ԽС��
��3�����ݻ�ѧ��Ӧǰ��ѹǿ֮�ȵ������ʵ���֮�������㣻
��4������ͼ��֪�״�ȼ�ϵ���ǵ�Դ�����ձ��е�װ��Ϊ���أ����õ��غ�ԭ������������
�ڸ��ݵ����غ���м��㣻
��5�����ݸ�˹���������㷴Ӧ���ʱ䲢��д�Ȼ�ѧ����ʽ��
����⣺��1������ͼʾ��Ϣ�����ﵽ��ѧƽ���Ժ״���������ߵ㣩�������¶ȣ��״������������С��˵��ƽ�������ƶ������Ը÷�Ӧ��һ�����ȷ�Ӧ���ʴ�Ϊ������
��2�����ڷ��ȷ�Ӧ�������¶ȣ�K��С���ʴ�Ϊ������
��3����������õ���CO��g��+2H2��g��?CH3OH��g��
��ʼ���ʵ�����mol�� 2.5 7.5 0
�仯�����ʵ�����mol�� 2.25 4.5 2.25
ƽ������ʵ��� ��mol��0.25 3 2.25
���Դ�ʱ�����ڵ�ѹǿ�Ϳ�ʼʱ�ı�ֵΪ��
=0.55���ʴ�Ϊ��0.55��
��4������ͼ��֪���״�ȼ�ϵ����ͨ��������Ϊ������bΪ��صĸ�������ߵ��ձ�Ϊ����װ�ã�п��b��������п��Ϊ������CuΪ������װ���൱���ڽ���п�϶�ͭ��п����Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+��
�ʴ�Ϊ��п����Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+��
�ڸ���Cu�缫��Ӧ��Cu=2e-+Cu2+����ͭƬ�������仯Ϊ12.8gʱ��ת�Ƶ�����0.4mol��
a���ϵ缫��Ӧ��O2+4e-+2H2O-�T4OH-��ת�Ƶ�����0.4molʱ�����ĵ�O2�ڱ�״���µ����Ϊ2.24L��
�ʴ�Ϊ��2.24��
��5����2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H1=+1411.0kJ/mol
��2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H2=+1366.8kJ/mol
���ݸ�˹���ɷ�ӦC2H4��g��+H2O��l���TC2H5OH��l�����ڢ�-�٣����ԡ�H=��H2-��H1=-44.2 kJ/mol��
�ʴ�Ϊ��C2H4��g��+H2O��l���TC2H5OH����H=-44.2 kJ/mol��
��2�����ڷ��ȷ�Ӧ�������¶ȣ�K��С���ʴ�Ϊ������
��3����������õ���CO��g��+2H2��g��?CH3OH��g��
��ʼ���ʵ�����mol�� 2.5 7.5 0
�仯�����ʵ�����mol�� 2.25 4.5 2.25
ƽ������ʵ��� ��mol��0.25 3 2.25
���Դ�ʱ�����ڵ�ѹǿ�Ϳ�ʼʱ�ı�ֵΪ��
| 0.25+3+2.25 |
| 2.5+7.5 |
��4������ͼ��֪���״�ȼ�ϵ����ͨ��������Ϊ������bΪ��صĸ�������ߵ��ձ�Ϊ����װ�ã�п��b��������п��Ϊ������CuΪ������װ���൱���ڽ���п�϶�ͭ��п����Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+��
�ʴ�Ϊ��п����Cu2++2e-=Cu��Cu����Cu=2e-+Cu2+��
�ڸ���Cu�缫��Ӧ��Cu=2e-+Cu2+����ͭƬ�������仯Ϊ12.8gʱ��ת�Ƶ�����0.4mol��
a���ϵ缫��Ӧ��O2+4e-+2H2O-�T4OH-��ת�Ƶ�����0.4molʱ�����ĵ�O2�ڱ�״���µ����Ϊ2.24L��
�ʴ�Ϊ��2.24��
��5����2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H1=+1411.0kJ/mol
��2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H2=+1366.8kJ/mol
���ݸ�˹���ɷ�ӦC2H4��g��+H2O��l���TC2H5OH��l�����ڢ�-�٣����ԡ�H=��H2-��H1=-44.2 kJ/mol��
�ʴ�Ϊ��C2H4��g��+H2O��l���TC2H5OH����H=-44.2 kJ/mol��
���������⿼��ѧ���йص绯ѧ���Ȼ�ѧ�Լ���ѧƽ����йؼ�����ۺ�֪ʶ�����Ը��ݽ̲�֪ʶ���ش��ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ
 һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g��
һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO��g��+2H2��g��?CH3OH��g��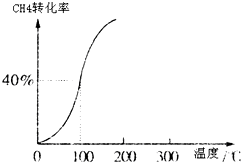 �ϳɰ���ũҵ���������������������Ҫ���壮
�ϳɰ���ũҵ���������������������Ҫ���壮