题目内容
 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.(1)在恒温恒容密闭容器中进行的合成氨反应,N2(g)+3H2(g)?2NH3(g),下列能表示达到平衡状态的是
ac
ac
(填序号).a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
Ⅱ、能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
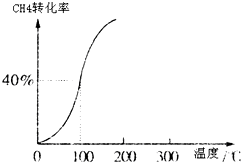
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
0.0024mol/L?min
0.0024mol/L?min
;②100℃时反应的平衡常数为
7.2×10-5(mol/L)2
7.2×10-5(mol/L)2
.(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应CO(g)+2H2(g)?CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的
| 1 | 2 |
CD
CD
(填字母序号).A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
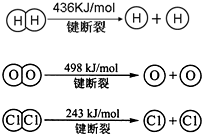
(3)已知:反应:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-116kJ/mol,H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
Ⅱ.
请回答:
①H2与O2反应生成气态水的热化学方程式是
2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol
.②断开1mol H-O 键所需能量约为
463.5
463.5
kJ.分析:I、(1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不再发生变化,由此衍生的一些物理性不变,以此解答该题;
II、(1)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,依据反应速率概念计算;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行;(3)①依据热化学方程式的方法和注意问题书写;标注物质聚集状态和焓变;
②依据氢气和氧气反应生成水的焓变和化学键的键能计算,△H=拆化学键吸收的能量-形成化学键放出的能量.
II、(1)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,依据反应速率概念计算;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
②依据氢气和氧气反应生成水的焓变和化学键的键能计算,△H=拆化学键吸收的能量-形成化学键放出的能量.
解答:解:I、(1)a.该反应随反应进行,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡,故a正确;
b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确;
d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,故d错误;
e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,故e错误;
故答案为:a c;
II、(1)①)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H2表示该反应的平均反应速率=
=0.0024mol/L?min;故答案为:0.0024mol/L?min;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
=
=7.2×10-5(mol/L)2
故答案为:7.2×10-5(mol/L)2;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行.
A、体积减小,c(H2)增大,故A错误;
B、压强增大,正逆反应速率都加快,故B错误;
C、体积减小,压强增大,平衡正向进行,CH3OH的物质的量增加,故C正确;
D、体积减小,压强增大,平衡正向进行,重新平衡时
减小,故D正确;
E、平衡常数K只随温度的而变化,故E错误;
故选CD;
(3)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol,
依据盖斯定律:①+②×2得到热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol;
②依据反应的热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,
则得到H-O的键能=463.5kJ,故答案为:463.5.
b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确;
d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,故d错误;
e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,故e错误;
故答案为:a c;
II、(1)①)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H2表示该反应的平均反应速率=
| ||
| 5min |
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
| [CO][H 2]3 |
| [CH4][H2O] |
| 0.004×0.0123 |
| 0.006×0.016 |
故答案为:7.2×10-5(mol/L)2;
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
A、体积减小,c(H2)增大,故A错误;
B、压强增大,正逆反应速率都加快,故B错误;
C、体积减小,压强增大,平衡正向进行,CH3OH的物质的量增加,故C正确;
D、体积减小,压强增大,平衡正向进行,重新平衡时
| c(H2) |
| c(CH3OH) |
E、平衡常数K只随温度的而变化,故E错误;
故选CD;
(3)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol,
依据盖斯定律:①+②×2得到热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol;
②依据反应的热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ/mol,
△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,
则得到H-O的键能=463.5kJ,故答案为:463.5.
点评:本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,键能计算焓变的方法,电子式的书写方法,难度较大.

练习册系列答案
相关题目
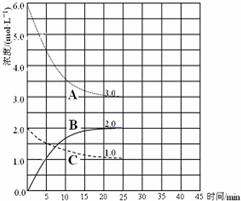 合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象
合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象下列说法正确的是( )
| A、前25min内,用H2浓度变化表示的化学反应平均速率是0.04 mol?L-1?min-1 | B、在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=0.148 | C、该反应达到平衡时放出热量为92kJ | D、V正(N2)=2V逆(NH3)说明到达平衡状态 |
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义. 2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1