题目内容
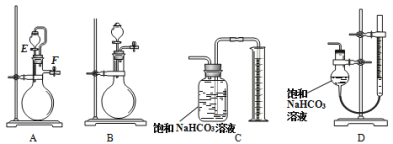
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取

(1)仪器a的名称是__________________。
(2)装置C、D、E盛装的试剂分别是_______________(填代号)。
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案 ____。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)
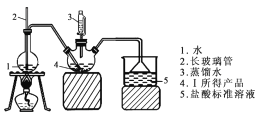
(4)三颈烧瓶中发生反应的化学方程式为 _________________________________。
(5)装置中长玻璃管的作用原理是_________。
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为__________________。
(7)产品纯度为_____________。(保留三位有效数字)
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是____________(填字母)。
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
【答案】蒸馏烧瓶 甲丙乙 在装置F后连接一个盛有碱石灰的干燥管(或其他合理答案) Sr3N2 + 6H2O=3Sr(OH)2 + 2NH3↑ 当装置1中压力过大时,安全管中液面上升,使装置1中压力稳定 甲基橙 97.3% ac
【解析】
Ⅰ.含有少量CO、CO2、O2等气体杂质的氮气依次通过NaOH溶液、连苯三酚碱性溶液、醋酸二氨合亚铜溶液、浓硫酸,达到依次除CO2、O2和CO,并干燥的目的;
Ⅱ.用一定量的盐酸吸收反应Sr3N2 + 6H2O=3Sr(OH)2 + 2NH3↑中生成的氨气,吸收液用NaOH溶液滴定,根据消耗的NaOH标准液的量可计算剩余HCl的量,再结合实际吸收氨气消耗的HCl的量计算出反应中生成的氨气,由氨气可计算样品的纯度。
Ⅰ.(1)仪器a的名称是蒸馏烧瓶;
(2)因醋酸二氨合亚铜溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力,且最后气体需要干燥,防氮化锶遇水剧烈反应,则混合气体依次通过NaOH溶液、连苯三酚碱性溶液、醋酸二氨合亚铜溶液、浓硫酸,即装置C、D、E盛装的试剂分别是甲、丙、乙;
(3)F装置直接与空气相通,空气中水蒸气可能会进入F装置中与氮化锶反应,导致产品变质,则应该在装置F后连接一个盛有碱石灰的干燥管;
Ⅱ.(4)Sr3N2 在水中水解生成Sr(OH)2 和NH3,则三颈烧瓶中发生反应的化学方程式为Sr3N2 + 6H2O=3Sr(OH)2 + 2NH3↑;
(5)装置中长玻璃管与外界相通,当装置1中压力过大时,安全管中液面上升,使装置1中压力稳定,起稳压作用;
(6)NaOH溶液和盐酸溶液恰好反应后呈中性,但溶液中还有氯化铵,为防止氢氧化钠和铵盐反应,可以选择酸性变色范围内的指示剂,则应选取甲基橙作指示剂;
(7)用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液,则剩余HCl的物质的量为1.00 mol/L×0.016L×![]() =0.16mol,反应中生成的NH3的物质的量为0.2L×1.00 mol/L-0.16mol =0.2mol-0.16mol=0.04mol,产品纯度为
=0.16mol,反应中生成的NH3的物质的量为0.2L×1.00 mol/L-0.16mol =0.2mol-0.16mol=0.04mol,产品纯度为 =97.3%;
=97.3%;
(8)a.滴定前碱式滴定管未排气泡,滴定后气泡消失,则消耗的NaOH标准溶液体积偏大,过量的HCl的物质的量偏大,导致测定结果偏低,故a正确;
b.读数时,滴定前平视,滴定后俯视,则消耗的NaOH标准溶液体积偏小,过量的HCl的物质的量偏小,导致测定结果偏高,故b错误;
c.滴定后,碱式滴定管尖嘴外还悬着一滴液体,则消耗的NaOH标准溶液体积偏大,过量的HCl的物质的量偏大,导致测定结果偏低,故c正确;
故答案为ac。

 灵星计算小达人系列答案
灵星计算小达人系列答案