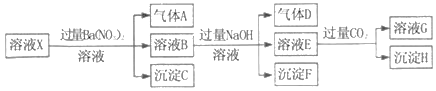
题目内容
【题目】0.1molH2SO4的质量为_________g,配制成500mL溶液后,H2SO4的物质的量浓度为__________mol/L,其中SO42-的物质的量浓度为________mol/L,H+的物质的量浓度为_________mol/L,跟足量的锌完全反应生成的氢气在标准状况下所占的体积为_________L。
【答案】 9.8 0.2 0.2 0.4 22.4
【解析】0.1molH2SO4的质量为0.1mol ×98g/mol=9.8g,配制成500mL溶液后,H2SO4的物质的量浓度为![]() =0.2mol/L,H2SO4=2H++ SO42-,其中SO42-的物质的量浓度为0.2mol/L,H+的物质的量浓度为0.2mol/L×2=0.4mol/L,跟足量的锌完全反应生成的氢气的方程式为:Zn+ H2SO4= ZnSO4+ H2↑,生成氢气的物质的量为0.1mol,在标准状况下所占的体积为0.1mol×22.4L/mol=2.24L。
=0.2mol/L,H2SO4=2H++ SO42-,其中SO42-的物质的量浓度为0.2mol/L,H+的物质的量浓度为0.2mol/L×2=0.4mol/L,跟足量的锌完全反应生成的氢气的方程式为:Zn+ H2SO4= ZnSO4+ H2↑,生成氢气的物质的量为0.1mol,在标准状况下所占的体积为0.1mol×22.4L/mol=2.24L。

练习册系列答案
相关题目