题目内容
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
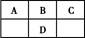
| 元素 | A | B | C | D |
| 性质结构信息 | 原子中最外层电子数为电子层数的2倍。常温下为淡黄色固体,其燃烧热为Q KJ/mol | 单质常温、常压下是气体,能溶于水。原子的M层p轨道有1个未成对的电子 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。 |
(1)写出A的燃烧热方程式 。
(2)写出B单质与水反应的化学方程式 。
(3)电解B与C的化合物水溶液是重要化学工艺,写出离子方程式 。
(4)A与C形成的化合物存在的化学键为 (填“共价键”或“离子键”)。
(5)A、B、D三种元素电负性由小到大的顺序为 (写元素符号)。
(6)B、D两元素非金属性较弱的是 (写元素符号)。请设计一个实验证明这一结论: 。
(1)S(s) + O2(g) = SO2(g) △H="-Q" KJ/mol
(2)Cl2 + H2O ="HCl" + HClO
(3)2Cl- + 2H2O Cl2 ↑+H2 ↑+2OH-
Cl2 ↑+H2 ↑+2OH-
(4)离子键
(5)Si S Cl
(6)Si, 取高氯酸溶液少量加入硅酸钠溶液中,若有白色沉淀生成,证明高氯酸酸性强于硅酸,(合理即可)
解析试题分析:(1)A原子中最外层电子数为电子层数的2倍,则该原子的最外层有4个或6个电子,且常温下为淡黄色固体,所以A为硫元素,则A燃烧的热化学方程式为S(s)+O2(g)=SO2(g) △H="-Q" KJ/mol
(2)B原子的M层p轨道有1个未成对的电子且常温下是气体,则B为氯元素,氯气与水反应的化学方程式为Cl2 + H2O ="HCl" + HclO
(3)C单质在空气中燃烧发出黄色的火焰。则C为钠,电解氯化钠溶液的离子方程式为2Cl- + 2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(4)A与C形成的化合物即硫化钠,该化合物中只存在离子键
(5)原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。则D为硅元素,根据同周期元素的电负性随核电荷数增加而增强,所以S、Cl、Si三种元素的电负性由小到大的顺序为Si、S、Cl
(6)Cl、Si中非金属性较弱的是Si,只要证明HClO4酸性大于H2SiO3酸性即可。取高氯酸溶液少量加入硅酸钠溶液中,若有白色沉淀生成,证明高氯酸酸性强于硅酸,
考点:考查元素推断、方程式的书写、化学键的判断、非金属性、电负性强弱的比较

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子 个数比 | N(A):N(C) =2:1 | N(A):N(C) =1:1 | N(B):N(A) =1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子 个数比 | N(D):N(B):N(C) =2:1:3 | N(E):N(F) =1:3 | N(B):N(F) =1:4 |
请完成下列问题:
(1)D的离子结构示意图为________,己的空间构型是________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为________ mol。
(3)8 g丙完全燃烧,生成液态水和CO2,放出445 kJ的热量,则丙燃烧的热化学方程式为________。
(4)F的单质与甲反应的离子方程式为________。
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为________。
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/molX3W+(aq)+WX(aq)=2X2W(1) ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
 杂化
杂化 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子 中不存在______________________________________。
中不存在______________________________________。 CO2(g)+H2(g)
CO2(g)+H2(g)