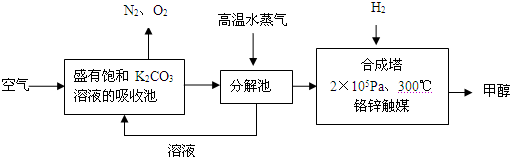
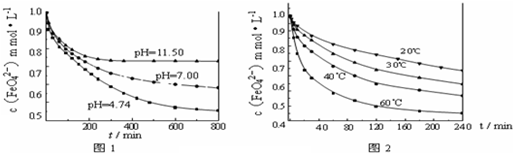
题目内容
(1)-5 ℃时,高氙酸钠(Na4XeO6)能跟浓硫酸反应生成XeO4气体。XeO4极不稳定,固体XeO4在-40 ℃也可能发生爆炸生成氙气和氧气。请分别写出两个反应的化学方程式:___________________________________;__________________________________________。(2)Xe的原子序数为54,Xe核外M层和N层的电子数分别为______________和____________。
(3)高氙酸钠(Na4XeO6)用于分析锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn2+氧化成MnO![]() ,生成XeO3。高氙酸钠在水溶液中已发生了如下反应:Na4XeO6+H2O══NaOH+Na3HXeO6,请写出高氙酸钠溶液和硫酸锰的硫酸水溶液反应的离子方程式:________________,若有1 mol Na4XeO6参加反应,转移电子_________mol。
,生成XeO3。高氙酸钠在水溶液中已发生了如下反应:Na4XeO6+H2O══NaOH+Na3HXeO6,请写出高氙酸钠溶液和硫酸锰的硫酸水溶液反应的离子方程式:________________,若有1 mol Na4XeO6参加反应,转移电子_________mol。
(1)Na4XeO6+2H2SO4(浓) ══XeO4↑+2Na2SO4+2H2O
XeO4══Xe+2O2
(2)18 18
(3)5HXeO![]() +2Mn 2++9H+══2MnO
+2Mn 2++9H+══2MnO![]() +5XeO3+7H2O 2
+5XeO3+7H2O 2
解析:(1)从Na3XeO4![]() XeO4的变化中,无化合价升降,应考虑复分解反应。(2)应将稀有气体的原子序数、位置、结构特点熟练记忆。在推断原子序数较大的元素时显得尤为重要。(3)要注意题给信息:氙在溶液中存在形式为HXeO
XeO4的变化中,无化合价升降,应考虑复分解反应。(2)应将稀有气体的原子序数、位置、结构特点熟练记忆。在推断原子序数较大的元素时显得尤为重要。(3)要注意题给信息:氙在溶液中存在形式为HXeO![]() ,又是酸性条件下的反应,而得失电子守恒是配平离子方程式的关键。会正确解读配平的离子方程式,这是计算电子转移的前提。本题将离子反应、氧化还原、化学计算融为一体,较好地考查考生的综合应变能力。
,又是酸性条件下的反应,而得失电子守恒是配平离子方程式的关键。会正确解读配平的离子方程式,这是计算电子转移的前提。本题将离子反应、氧化还原、化学计算融为一体,较好地考查考生的综合应变能力。

练习册系列答案
相关题目
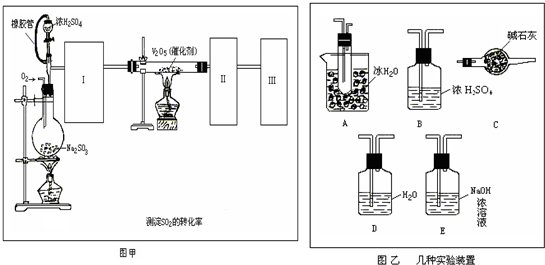
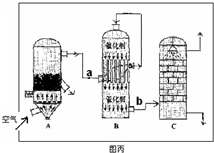

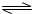 HClO+OH-
HClO+OH-