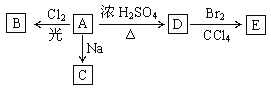
题目内容
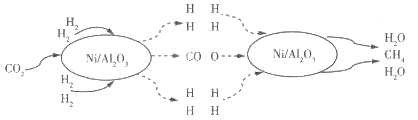
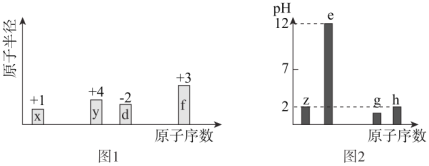
【题目】有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是______;
(2)比较d、e、f的简单离子半径大小为 < < (用离子符号表示)______;y、h的最高价氧化物对应水化物酸性较强的是______ (用化学式表示);
(3)下列可作为比较c和f金属性强弱的依据是______;
①测同温同压同浓度相应氯化物水溶液的pH
②测两种元素单质的硬度和熔、沸点
③比较单质作还原剂时失去的电子数目的多少
④比较两种元素在化合物中化合价的高低
⑤比较单质与同浓度盐酸反应的难易程度
(4)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者的水溶液均呈碱性,该反应的化学方程式为______。已知eyz含有Z2分子中类似的化学键,写出化合物eyz的电子式___。
【答案】第三周期第VIA族 Al3+<Na+<O2-; HClO4 ①⑤ NaCN+H2O2+H2O=NaHCO3+NH3↑ Na+[![]() ]-
]-
【解析】
从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,f是Al元素,z、e、g、h的最高价氧化物对应水化物溶液浓度均为0.01molL-1,e的pH为12,为一元强碱,则e是Na元素,z、h的pH均为2,为一元强酸,则z为N元素、h为Cl元素;g的pH小于2,则g的为二元强酸,故g为S元素,据此分析结合元素性质解答。
(1) g为S元素,原子序数为16在周期表中位于第三周期第VIA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,则离子半径:Al3+<Na+<O2-;非金属性Cl>C,则最高价氧化物对应水化物的酸性最强的为HClO4;
(3)①溶液pH越小,金属阳离子水解程度越大,金属阳离子对应的碱越弱,则对应元素的金属性越弱,故①正确;
②单质的硬度和熔、沸点,属于物理性质,不能比较金属强弱,故②错误;
③化合物中金属元素化合价越高,说明金属原子失去电子能力越强,但金属性强弱与失去电子数目无关,与失电子难易有关,故③错误;
④元素化合价高低与金属性无关,故④错误;
⑤单质与同浓度盐酸反应越剧烈,说明金属性越强,故⑤正确;
答案选① ⑤;
(4)y是C元素,z是N元素,e是Na元素,化合物NaCN不慎泄露时,通常采用喷洒过氧化氢溶液的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,应生成NaHCO3、NH3,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑,NaCN由Na+、CN构成,含有N2分子中类似的化学键,则CN中存在三键,NaCN电子式为Na+[![]() ]-。
]-。

 阅读快车系列答案
阅读快车系列答案【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
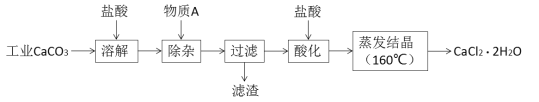
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。