题目内容
电解原理在化学工业中有广泛的应用。如下图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连。

(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,试判断:
①a是________极(填“正”或“负”),B是________极(填“阴”或“阳”);
②A电极上的电极反应式为
________________________________________________________________________,
B电极上的电极反应式为
________________________________________________________________________;
③检验A电极产物的方法是
________________________________________________________________________
________________________________________________________________________。
(2)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则
①A电极的材料是________,电极反应式为
________________________________________________________________________
______________;
②B电极的材料是________,电极反应式为
________________________________________________________________________
______________。
(3)用惰性电极电解CuSO4溶液。若阴极上析出Cu的质量为3.2 g,则阳极上产生的气体在标准状况下的体积为________;常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为________。
(1)①正 阴
②2Cl-===Cl2↑+2e- 2H++2e-===H2↑
③把湿润的淀粉碘化钾试纸放在A电极附近,观察颜色变化
(2)①粗铜 Cu===Cu2++2e-
②纯铜 Cu2++2e-===Cu
(3)0.56 L 1
【解析】
试题分析:(1)电流从正极流出,流入电解池的阳极,所以a是正极,B是阴极;A电极的反应式为:2Cl-===Cl2↑+2e-,B电极反应为:2H++2e-===H2↑;检验Cl2的方法一般用湿润的淀粉碘化钾试纸,Cl2能使试纸变蓝。也可以用湿润的有色布条或纸条,Cl2能使布条或纸条退色。
(3)电解的总反应方程式为:2Cu2++2H2O 2Cu+O2↑+4H+。当阴极上析出3.2 g Cu时,产生的O2在标况下的体积为0.56 L,同时产生的H+为0.1
mol,故pH=1。
2Cu+O2↑+4H+。当阴极上析出3.2 g Cu时,产生的O2在标况下的体积为0.56 L,同时产生的H+为0.1
mol,故pH=1。
考点:考查电解原理应用的有关判断和计算以及电极反应式的书写
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,主要是考查学生对电解池的电极反应、现象和电极反应式的书写等的掌握情况,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确电解的工作原理,并能依据电子的得失守恒灵活运用即可。

 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: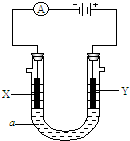 (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.