题目内容
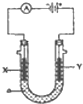 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有
(2)若要用电解方法精炼粗铜,则①电解液a选用
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是
分析:(1)若X是锌、Y是碳棒,a是氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电;
(2)若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,阳极上铜失电子发生氧化反应;
(3)若要在铁上镀银,镀层作阳极,镀件作阴极,电解质为含有与阳极材料相同金属元素的可溶性盐,阴极上银离子得电子发生还原反应.
(2)若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,阳极上铜失电子发生氧化反应;
(3)若要在铁上镀银,镀层作阳极,镀件作阴极,电解质为含有与阳极材料相同金属元素的可溶性盐,阴极上银离子得电子发生还原反应.
解答:解:(1)①若X是锌、Y是碳棒,a是氯化钠溶液,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,则该原理可制得化工原料氢气、氯气和氢氧化钠,故答案为:氢气、氯气和氢氧化钠;
②Y电极上氯离子反应生成氯气,电极反应式为2Cl-+2e=Cl2↑,故答案为:2Cl-+2e=Cl2↑;
(2)①若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,如硫酸铜,则a为硫酸铜溶液,故答案为:CuSO4溶液;
②Y电极上铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)①若要在铁上镀银,镀层作阳极,镀件作阴极,要想在铁上镀银,则阳极材料是Ag,故答案为:Ag;
②X电极上银离子得电子生成银,电极反应式为Ag++e-=Ag,故答案为:Ag++e-=Ag.
②Y电极上氯离子反应生成氯气,电极反应式为2Cl-+2e=Cl2↑,故答案为:2Cl-+2e=Cl2↑;
(2)①若要用电解方法精炼粗铜,阳极为粗铜,阴极为纯铜,电解质为可溶性的铜盐,如硫酸铜,则a为硫酸铜溶液,故答案为:CuSO4溶液;
②Y电极上铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
(3)①若要在铁上镀银,镀层作阳极,镀件作阴极,要想在铁上镀银,则阳极材料是Ag,故答案为:Ag;
②X电极上银离子得电子生成银,电极反应式为Ag++e-=Ag,故答案为:Ag++e-=Ag.
点评:本题以电解原理为载体考查了电镀和电解精炼,明确电镀时镀层和镀件分别作哪种电极、电解精炼时混合物和纯净物分别作哪种电极、阳极材料与电解质溶液的关系是解本题关键,难度不大.

练习册系列答案
相关题目
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
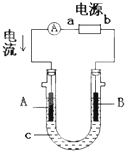 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.