题目内容
已知25℃时,Ksp(AgI)=8.5×10-17,Ksp(AgCl)=1.8×10-10,若在5mL含有KCl和KI均为0.01mol?L-1的溶液中,缓慢滴加8mL 0.01moL-1 AgNO3溶液,下列叙述正确的是( )
| A、混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | ||
| B、混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C、加入AgNO3溶液时首先生成AgCl沉淀 | ||
D、混合溶液中
|
考点:离子浓度大小的比较,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:Ksp(AgI)<Ksp(AgCl),所以先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol?L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol?L-1×8 mL-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol?L-1×5 mL=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀.
解答:
解:A.Ksp(AgI)<Ksp(AgCl),所以先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol?L-1×0.005 L=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol?L-1×0.008 L-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol?L-1×0.005 L=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,n(KNO3)=n(AgNO3)=0.01 mol?L-1×0.008 L=8×10-5 mol,n(KCl)=5.0×10-5 mol,根据物料守恒得离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-),溶液中还存在氯离子,所以银离子浓度较小,碘化银溶度积常数最小,所以碘离子浓度最小,所以离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故A错误;
B.根据A知,离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故B正确;
C.Ksp(AgI)<Ksp(AgCl),所以先生成AgI,再生成AgCl,故C错误;
D.混合溶液中
=
=
=2×106,故D错误;
故选B.
B.根据A知,离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故B正确;
C.Ksp(AgI)<Ksp(AgCl),所以先生成AgI,再生成AgCl,故C错误;
D.混合溶液中
| c (Cl-) |
| c (l-) |
| ||
|
| 1.8×10-10 |
| 8.5×10-17 |
故选B.
点评:本题考查了离子浓度大小比较,明确物质之间的反应及溶液中存在的溶质是解本题关键,会根据溶度积常数确定离子反应先后顺序,注意D中两种离子浓度之比的计算方法,为难点.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
关于如图所示装置的叙述,正确的是( )


| A、铜是负极,铜片上有气泡产生 |
| B、铜片质量没有变化 |
| C、电流从锌片经导线流向铜片 |
| D、氢离子在铜片表面被氧化 |
下列说法正确的是( )
| A、铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | ||||
| B、燃放的焰火是某些金属元素焰色反应所呈现出来的色彩,焰色反应属于化学变化 | ||||
| C、利用丁达尔现象可以区分氢氧化铁胶体和硫酸铜溶液 | ||||
D、工业上制粗硅的主要反应SiO2+C
|
下列说法中(NA代表阿伏加德罗常数),不正确的是( )
| A、常温常压下,18g H2O含有的原子总数为3NA |
| B、标准状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| C、常温下,2.3g Na完全与O2反应失去的电子数为0.1NA |
| D、在密闭容器中加入1.5mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA |
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )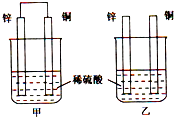

| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中正极的电极反应式为Zn-2e-=Zn2+ |
| C、两烧杯中氢离子浓度均减少 |
| D、产生气泡的速度甲比乙慢 |
将2.3g钠溶于100g水中,所得溶质的质量分数为( )
| A、2.25% |
| B、2.30% |
| C、3.91% |
| D、4.00% |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,48g O2和O3组成的混和气体中所含的氧原子数为3NA |
| B、2mol H2O中含有36NA个电子 |
| C、2L 0.1mol?L-1 H2SO4溶液中含有0.2NA个H+ |
| D、常温常压下,22.4L CH4中含有NA个CH4分子 |
下列实验中,溶液颜色有明显变化的是( )
| A、少量明矾溶液加入到过量NaOH溶液中 |
| B、往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液 |
| C、少量Na2O2固体加入到过量NaHSO3溶液中 |
| D、往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3溶液 |
对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| B、达到化学平衡时,4v正(O2)=5v逆(NO) |
| C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D、化学反应速率关系是:v(正)>v(逆) |