题目内容
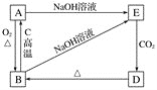
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如下图,已知沉淀2为蓝色。
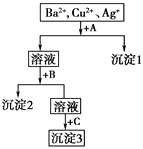
(1)写出沉淀的化学式:沉淀1______;沉淀3________。
(2)写出混合液+A的离子方程式_________________,溶液+B的离子方程式________________。
【答案】AgCl BaSO4Ag++Cl=== AgCl↓H++OH=== H2O,Cu2++2OH=== Cu(OH)2↓
【解析】
(1)根据沉淀2为蓝色可推断沉淀2为氢氧化铜,溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后再加入NaOH得到Cu(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,所以沉淀1是氯化银,沉淀2是氢氧化铜,沉淀3是硫酸钡;
(2)混合液+A反应的离子方程式为Ag++Cl=== AgCl↓,沉淀2为Cu(OH)2,溶液中含有过量的氢离子,溶液+B反应的离子方程式为:H++OHH2O,Cu2++2OH=== Cu(OH)2↓。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目