题目内容
【题目】通过反应 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
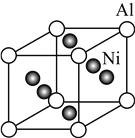
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。
【答案】 [Ar]3d7或1s22s22p63s23p63d7 sp和sp2 14 mol N>O>C>Na 乙醇分子间存在氢键 Ni3Al
【解析】(1) Ni3+基态核外电子排布式为1s22s22p63s23p63d7或[Ar]3d7
(2)异氰酸苯酯分子中,苯环上碳原子是sp2杂化,而—N=C=O中的碳原子是sp杂化;1mol 异氰酸苯酯分子中,苯环上含有11个σ键,而—N=C=O中含有3个σ键,所以共计14molσ键,即14NA;
(3)在元素周期表中,第一电离能的一般规律是同周期从左向右逐渐增大,同主族从上到下逐渐减小,所以Na、O、C、N四种元素的第一电离能从大到小的顺序为N >O> C> Na;
(4) C2H5OH 在分子间可形成氢键,而![]() 不能形成分子间氢键,所以C2H5OH 的沸点高于
不能形成分子间氢键,所以C2H5OH 的沸点高于![]() ;
;
(5)根据原子均滩法,该晶胞中Al原子数=![]() =1,Ni原子数=
=1,Ni原子数= ![]() =3,所以该合金的化学式为Ni3Al。
=3,所以该合金的化学式为Ni3Al。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目